Нанокристаллический диоксид церия является одним из наиболее перспективных наноматериалов для биомедицинского применения [1–3]. Наночастицы диоксида церия (НДЦ) обладают способностью влиять на протекание редокс-процессов в живых клетках [4, 5], что обуславливает их биологическую активность и сравнительно низкую токсичность in vitro [6–8]. Таким образом, одной из актуальных задач при исследовании биологической активности НДЦ является исследование путей интернализации и внутриклеточной локализации синтезированных наночастиц в различных видах клеток.
Для исследования механизмов биологической активности и мониторинга накопления наночастиц в живой клетке in vitro необходимо проводить их функционализацию люминесцентными метками. Для этих целей синтезируют наночастицы стабилизированные полимерными молекулами, в качестве которых могут выступать полисахариды, с последующей фиксацией на их поверхности люминесцентной метки, например, флуоресцеин-5-изотиоцианат (ФИТЦ). Такой подход позволяет получать биосовместимые, стабильные высокодисперсные золи наночастиц с контролируемой морфологией и возможностью их визуализации в клеточных системах in vitro.
Цель исследования – провести анализ цитотоксичности и внутриклеточной локализации НДЦ, модифицированных ФИТЦ, в культурах нормальных (фибробласты мыши L929) и трансформированных (остеосаркома костной ткани человека MNNG) клеток in vitro.
Материалы и методы исследования
НДЦ, стабилизированные мальтодекстрином, были синтезированы методом, описанным ранее [9]. Затем стабилизированные НДЦ функционализировали люминесцентной меткой путем растворения порошка синтезированных НДЦ в деионизированной воде при 95°C и добавления флуоресцеин-5-изотиоцианата. После раствор охлаждали и добавляли 50 мл изопропилового спирта. Выпавший осадок отделяли центрифугированием (10000 g, 10 мин), затем осадок промывали изопропиловым спиртом и высушивали в темноте при 60 °C. Очищенный ярко-желтый золь наночастиц получали с использованием диализа. Затем проводили анализ размеров, полученных наночастиц методом динамического светорассеяния (Malvern Zetasizer Nano ZS), который выявил, что гидродинамический диаметр наночастиц без ультразвуковой обработки составлял в среднем 30 нм (Синтез #1), тогда как при обработке в ультразвуковой ванне (суммарно 24 ч) гидродинамический диаметр уменьшался в среднем до 3 нм (Синтез #2).
В работе были использованы клеточные линии из коллекции клеточных культур Лаборатории тераностики и ядерной медицины ИТЭБ РАН: фибробласты мыши (NCTC L929) и остеосаркома костной ткани человека (MNNG/HOS). Клетки культивировали в среде DMEM/F12 (1:1) с добавлением 10 % бычьей эмбриональной сыворотки. Культивирование клеточных культур проводили в 96-луночных планшетах в плотности 30000 клеток/см2. При исследовании биодоступности наночастиц исходную среду заменяли на растворы исследуемых образцов в среде DMEM/F12 с добавлением 10 % бычьей эмбриональной сыворотки. Затем клетки инкубировали в присутствии тестируемых образцов в течение 24, 48 и 72 ч.
Анализ цитотоксичности проводили с использованием МТТ-теста и селективного окрашивания флуоресцентными красителями. Определение метаболической активности в живых клетках проводили с помощью МТТ-анализа, основанного на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-мл]-2,5-дифенилтетразолия бромид, МТТ) до формазана, который имеет пурпурное окрашивание. После инкубации клеток в присутствии образцов среду заменяли на раствор МТТ в среде DMEM/F12 без сыворотки в концентрации 0,5 мг/мл. Через 3 ч среду с МТТ заменяли на ДМСО, планшеты помещали на шейкер при температуре 37°C на 10 мин, после чего измеряли оптическую плотность растворов в лунках планшетов при длине волны 570 нм. Значения оптической плотности пересчитывали в проценты от значений контрольной группы, отклонения в выборках указывали в виде стандартного отклонения (SD). Значимость отклонений между выборками и контролем подтверждали с использованием t-критерия Уэлча при 0,01 < p < 0,05 (*) и 0,001 < p < 0,01 (**) с использованием GraphPad Prism.
Жизнеспособность клеточных культур в присутствии образцов оценивали с использованием флуоресцентных красителей Hoechst 33342 (поглощение – 350 нм, эмиссия – 461 нм) и йодид пропидия (поглощение – 493, эмиссия – 636 нм) (LIVE/DEAD-тест). Для каждой группы клеток исследовали пять полей в каждой лунке с помощью микроскопа Carl Zeiss Axiovert 200. Соотношение клеток (общее количество клеток / количество мертвых клеток) рассчитывали с использованием программного обеспечения ImageJ.
Внутриклеточную локализацию двух типов (Синтез #1 и Синтез #2) НДЦ, меченных ФИТЦ, исследовали на культурах нормальных и трансформированных клеток. Клетки высевали на 96-луночные планшеты в плотности 30000 клеток/см2 и культивировали в среде DMEM/F12 с добавлением 10 % бычьей эмбриональной сыворотки. Разведения тестируемых образцов готовили с использованием среды DMEM/F12 с добавлением 10 % эмбриональной бычьей сыворотки в диапазоне концентраций от 25 до 500 мкл/мл. Для визуализации ядра и лизосом после 24 ч инкубации в присутствии ФИТЦ-меченных НДЦ были использованы флуоресцентные красители: Hoechst 33342 – для окрашивания ядер клеток (голубой цвет) и LysoTracker Red – для окрашивания лизосом клеток (красный цвет). Наночастицы за счет ФИТЦ были окрашены в зеленый цвет (поглощение – 495 нм, эмиссия – 525 нм).
Результаты исследования и их обсуждение
1. Исследование влияния НДЦ, модифицированных ФИТЦ, на метаболитическую активность и жизнеспособность клеток NCTC L929 и MNNG/HOS
На рис. 1 показано влияние НДЦ, модифицированных ФИТЦ, на активность митохондриальных и цитоплазматических дегидрогеназ и жизнеспособность NCTC L929 и MNNG/HOS, оцененных методами МТТ- и LIVE/DEAD-тестов.
Из диаграмм на рис. 1, А, видно, что дегидрогеназная активность NCTC L929, оцененная по восстановлению МТТ, при инкубации в течение 72 ч в присутствии НДЦ Синтез #1 в концентрации 5 мг/мл, снижается на 47 ± 8 % относительно контроля. Метаболическая активность NCTC L929 в присутствии НДЦ Синтез #1 в концентрации от 0,1 мг/мл до 0,01 мг/мл увеличивается на 6 ± 2 % относительно контроля. При инкубации NCTC L929 в присутствии НДЦ Синтез #2 было показано снижение метаболической активности на 50 ± 3 % относительно контроля в концентрации 5 мг/мл. В диапазоне концентраций от 1 мг/мл до 0,01 мг/мл НДЦ Синтез #2 не было отмечено изменения дегидрогеназной активности клеток относительно контроля. Оценка жизнеспособности клеток NCTC L929 в присутствии НДЦ Синтез #1 и НДЦ Синтез #2 показывает отсутствие цитотоксического эффекта исследуемых наночастиц в диапазоне концентраций от 5 до 0,01 мг/мл после инкубации в течение 72 ч. В исследуемом диапазоне концентраций НДЦ, модифицированных ФИТЦ (от 5 до 0,01 мг/мл), для обоих образцов наночастиц (Синтез #1 и Синтез #2) для культуры нормальных клеток (NCTC L929) значения IC20 и IC50 не были обнаружены.
Из диаграмм на рис. 1, Б, видно, что дегидрогеназная активность MNNG/HOS при инкубации в присутствии НДЦ Синтез #1 в концентрации 5 мг/мл снижается на 57 ± 2 % относительно контроля. Напротив, в концентрации НДЦ Синтез #1 от 1 до 0,01 мг/мл дегидрогеназная активность MNNG/HOS увеличивается на 40 ± 3 % относительно контроля.
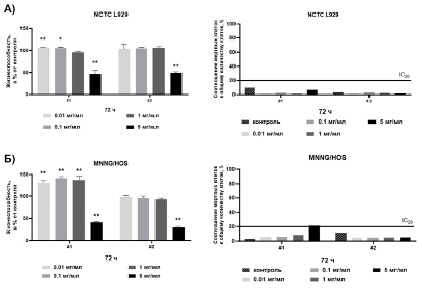
Рис. 1. Результаты МТТ- и LIVE/DEAD-тестов на NCTC L929 и MNNG/HOS in vitro. Тест проведен через 72 ч инкубации клеток в присутствии НДЦ в концентрациях от 5 до 0,01 мг/мл. Значимость отклонений между выборками и контролем подтверждалась с использованием t-критерия Уэлча при 0,01 < p < 0,05 (*), при 0,001 < р < 0,01 (**)
При инкубации MNNG/HOS в присутствии НДЦ Синтез #2 в концентрации 5 мг/мл дегидрогеназная активность клеток снижалась на 64 ± 3 %. Для НДЦ Синтез #2 в диапазоне концентраций от 1 до 0,01 мг/мл, так же как и в эксперименте с NCTC L929, не было отмечено изменения дегидрогеназной активности клеток MNNG/HOS относительно контроля. Оценка жизнеспособности клеток MNNG/HOS в присутствии НДЦ Синтез #1 в концентрации от 1 до 0,01 мг/мл и НДЦ Синтез #2 в концентрации от 5 до 0,01 мг/мл показывает отсутствие цитотоксического эффекта исследуемых наночастиц после инкубации в течение 72 ч. Однако для клеток MNNG/HOS было достигнуто значение IC20 при концентрации НДЦ Синтез #1 равной 5 мг/мл.
2. Внутриклеточная локализация НДЦ, модифицированных ФИТЦ, в культурах нормальных (NCTC L929) и раковых (MNNG/HOS) клеток
Для подбора рабочих концентраций НДЦ была использована клеточная культура NCTC L929, которую инкубировали от 3 до 72 ч в присутствии тестируемых образцов в концентрациях от 15 до 500 мкл/мл. Рабочей концентрацией ФИТЦ-меченных НДЦ выбиралась концентрация, при которой интенсивность свечения образцов была достаточной для визуальной оценки распределения наночастиц внутри клетки и не влияла значительно на жизнеспособность клеток. Рабочая концентрация красителей (Hoechst 33342, LysoTracker Red) для данных типов клеток была определена как 2 мкМ. Установлено, что накопление наночастиц происходит через 9–10 ч инкубации в обоих типах клеток. Оптимальное время инкубации, при котором поглощенные ФИТЦ-меченные НДЦ хорошо визуализировались внутри клеток, составило 24 ч. Таким образом, для проведения исследования внутриклеточной локализации исследуемых НДЦ, модифицированных ФИТЦ, было выбрано время инкубации 24 ч, а концентрации наночастиц составили для НДЦ Синтез #1 – 30 мкл/мл, для НДЦ Синтез #2 – 300 мкл/мл. Данные по внутриклеточной локализации НДЦ, модифицированных ФИТЦ, представлены на рис. 2 для NCTC L929 и на рис. 3 для MNNG/HOS.
Установлено, что максимальное накопление НДЦ внутри обоих типов клеточных культур происходит через 24 ч инкубации (рис. 2, 3). Однако показано, что большее накопление НДЦ, модифицированных ФИТЦ, как для наночастиц Синтез #1, так и для наночастиц Синтез #2 характерно для нормальной клеточной культуры (NCTC L929), что подтверждается более высоким уровнем зеленой флуоресценции. Как в нормальных, так и в трансформированных клеточных культурах ФИТЦ-меченные НДЦ локализуются преимущественно в цитоплазме и лизосомах, не попадая в ядра клеток. Данные подтверждаются микрофотографиями, полученными после обработки путем колокализации спектров (рис. 2, 3).
Для попадания внутрь клетки НДЦ должны пересечь клеточную мембрану, что возможно посредством ряда механизмов эндоцитоза: макропиноцитоза, клатрин-опосредованного эндоцитоза, кавеол-опосредованного эндоцитоза или клатрин/кавеол-независимого эндоцитотического механизма [10], а также поглощение наночастиц может происходить по пассивному механизму [11].
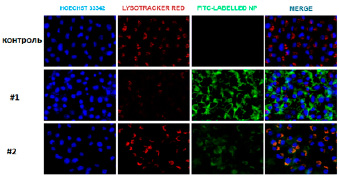
Рис. 2. Изображения культуры NCTC L929, полученные методом конфокальной флуоресцентной микроскопии. Hoechst 33342 – синий, Lysotracker Red – красный, FITC – зеленый, Merge – синий + красный + зеленый. Масштабная линейка = 30 мкм
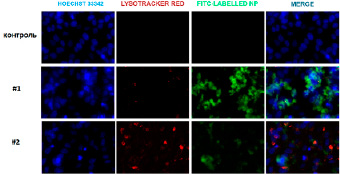
Рис. 3. Изображения культуры MNNG/HOS, полученные методом конфокальной флуоресцентной микроскопии. Hoechst 33342 – синий, Lysotracker Red – красный, FITC – зеленый, Merge – синий + красный + зеленый. Масштабная линейка = 30 мкм
Согласно литературным данным, в трансформированных клетках наблюдается более интенсивное и быстрое поглощение молекул или частиц, чем в нормальных клетках [12]. Однако данное предположение не согласуется с результатами, полученными нами на культурах NCTC L929 и MNNG/HOS, где наблюдается противоположный эффект. Это может быть связано с активацией рецепторов на поверхности нормальных клеток, и, таким образом, скорость рецептор-опосредованного эндоцитоза может быть увеличена. Поэтому, помимо локализации НДЦ внутри клетки, крайне актуально исследовать механизмы эндоцитоза, благодаря которым наночастицы проникают в клетку.
Заключение
Таким образом, полученные данные свидетельствуют о том, что для обоих типов НДЦ, модифицированных ФИТЦ, показано отсутствие достоверного цитотоксического эффекта на культурах как нормальных (NCTC L929), так и трансформированных (MNNG/HOS) клеток в концентрациях от 1 до 0,01 мг/мл. Оба исследованных типа НДЦ визуализируются внутри нормальных и трансформированных клеток при помощи конфокальной флуоресцентной микроскопии в концентрациях НДЦ Синтез #1 – 30 мкл/мл и для НДЦ Синтез #2 – 300 мкл/мл и локализуются преимущественно в цитоплазме и лизосомах, не попадая в ядра клеток.

