Сердечно-сосудистые заболевания (ССЗ) представляют собой огромную социально-экономическую проблему современного мира, так как занимают лидирующее место в структуре смертности и утраты трудоспособности в экономически развитых и развивающихся странах. В России показатели смертности от ССЗ составляют около 55– 55,7 % от общей смертности населения и в настоящее время являются самыми высокими в мире [1, 2]. Данная группа патологий стала более распространенной уже в более раннем возрасте и является ведущей причиной смертности населения во всем мире. К наиболее распространенным заболеваниям сердечно-сосудистой системы относятся ишемическая болезнь сердца, гипертоническая болезнь, сосудистые поражения головного мозга [3]. Несмотря на многочисленные плодотворные исследования, поиск эффективных способов профилактики ССЗ продолжается.
Установлено, что нейрон в состоянии адаптации переходит в режим экономии энергии, при котором нервные клетки на разных стадиях обладают определенными величинами импульсной активности [4]. Создание модели импульсной активности адаптированного нейрона для воздействия на организм человека является перспективным способом для нормализации деятельности организма, в особенности сердечно-сосудистой системы.
Цель исследования – определить влияние модельных сигналов адаптированного нейрона на физиологические показатели человека.
Материалы и методы исследования
В настоящем исследовании применялся новый способ дистантного воздействия на биологические объекты с помощью электроакустических сигналов в режиме, воспроизводящем параметры импульсной электрической активности нейронов, адаптированных к импульсной активности с помощью электроакустического генератора ЭСЛ-2. Способ воздействия ощущался как звуковой периодический сигнал. Участники исследования, молодые люди в возрасте 19–21 лет, были предварительно поделены на контрольную и опытную группы. Молодые люди в группе опыта ежедневно подвергались воздействию испытуемого фактора в течение пяти минут. Группа контроля вела привычный образ жизни и не подвергалась действию испытуемого фактора. Все испытуемые дали информированное согласие на участие в исследовании.
Для определения редуцированного артериального давления (РАД) была применена формула Лильештранда и Цандера [5]:
РАД = 100 (ПД / СрД),
где ПД – пульсовое давление (мм рт. ст.); СрД – среднее давление (мм рт. ст.).
Для вычисления систолического объема была использована следующая формула:
СО = 100 + (0,5×ПД) – (0,6×АДД) – (0,6×В),
где СО – систолический объем крови (мл), ПД – пульсовое давление (мм рт. ст.), АДД – артериальное давление диастолическое (мм рт. ст.) и В – возраст (лет).
Индекс Кердо вычислялся по известной формуле [6], при этом интерпретация результата была следующей: значения от −10 до +10 у.е. оценивались как уравновешенность симпатических и парасимпатических влияний, от +11 – симпатикотония, от −11 –парасимпатикотония. В научной литературе продолжает активно использоваться подход к типизации состояния человека на основе вегетативного индекса Кердо (ВИК), предложенного около 50 лет назад [7]. Достоверность результатов исследования оценивалась по критерию Стьюдента.
Результаты исследования и их обсуждение
Изменение систолического объема крови под влиянием испытуемого фактора приведено в табл. 1. Среднее фоновое значение систолического объема в группе контроля составило 58,16±2,03 мл. На 3, 5, 7-е дни наблюдений показатель составил в среднем 58,66±2,11, 64,23±2,01, 57,18±1,59 мл на 1, 3, 5 и 10-е дни соответственно. В период последействия отмечались скачки показателя от 59,47±3,02 до 64,03±1,73 мл. Очевидно, что в группе контроля, на которую не осуществлялось воздействие испытуемого фактора, наблюдались выраженные флуктуации показателя.
Фоновые значения СО в группе исследования в среднем составили 58,16±2,03 мл. В 1-й день воздействия происходит рост показателя до 62,51±1,9 мл. В дни воздействия показатель растет и к 10-му дню достигает нормы – 65,56*±1,87 мл. После прекращения действия фактора отмечаются показатели СО в пределах нормы. К концу периода последействия систолический объем в группе опыта составил 71,88±2,77 мл.
График изменений средних СО в исследуемых группах приведен на рис. 1.
Таблица 1
Динамика систолического объема крови (мл) человека под влиянием модельной комбинации частот нейрона
|
Фон |
Дни опыта (воздействия) |
Дни последействия |
|||||||
|
1 |
3 |
5 |
7 |
10 |
3 |
5 |
10 |
||
|
Опыт |
58,16±2,03 |
62,11±1,07 |
62,46±2,18 |
62,94±2,78 |
61,3±2,89 |
65,56*±1,87 |
66,31*±1,78 |
71,42*±2,16 |
71,88±2,77 |
|
Контроль |
60,55±1,77 |
58,66±2,11 |
64,1±1,11 |
64,23±2,01 |
57,18±1,59 |
62,23±1,17 |
59,47±3,02 |
64,03±1,73 |
60,38±1,76 |
Примечание: * р ≤ 0,05.
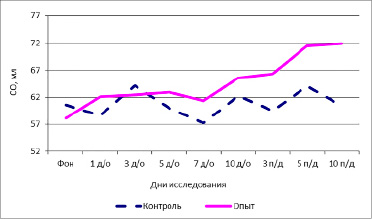
Рис. 1. Динамика СО крови человека под влиянием комплексного частотного нейрона
Очевидно, что значение СО в группе опыта плавно повышается, хотя вначале показатель был невысоким. В группе контроля показатель существенно не изменяется и претерпевает флуктуации.
В настоящей работе, помимо систолического объема, который описывает работу сердца, исследовалась и функция сосудистой системы. До начала исследования значение РАД в контроле в среднем составило 34,52±3,35 мм рт. ст. В первый день исследования происходит самопроизвольное незначительное снижение показателя до 33,5±3,55 мм рт. ст. К 7-му дню исследования происходит скачок РАД до 40,79±3,92 мм рт. ст., на 10-й день вновь небольшое снижение до 37,19±3,41 мм рт. ст.
Период последействия характеризовался более высокими значениями РАД. Так, на 3-й день оно составило в среднем 48,02±5,81 мм рт. ст. Фоновые значения исследуемого показателя в группе опыта составили в среднем 43,01±3,51 мм рт. ст. В 1-й день воздействия испытуемого фактора отмечается снижение показателя до 37,63±3,13 мм рт. ст. Однако к 10-му дню исследования отмечалось повышение РАД до 44,81±2,08 мм рт. ст.
Прекращение воздействия сопровождалось нестабильностью показателя. Однако к концу наблюдений, то есть на 10-й день последействия, происходит снижение давления до значений более оптимальных, чем фоновые – 37,64±3,98 мм рт. ст.
Таблица 2
Изменение редуцированного артериального давления (РАД) под влиянием модельной комбинации частот нейрона
|
Фон |
Дни опыта (воздействия) |
Дни последействия |
|||||||
|
1 |
3 |
5 |
7 |
10 |
3 |
5 |
10 |
||
|
Опыт |
43,01±3,51 |
37,63±3,13 |
40,59±4,12 |
37,87±2,2 |
35,66±3,46 |
44,81*±2,08 |
43,7*±2,25 |
50,0*±5,58 |
37,64±3,98 |
|
Контроль |
34,52±3,35 |
33,5±3,55 |
39,94±4,58 |
34,38±3,3 |
40,79±3,92 |
37,19±3,41 |
48,02*±5,81 |
41,02±2,89 |
35,96±2,28 |
Примечание: * р ≤ 0,05.
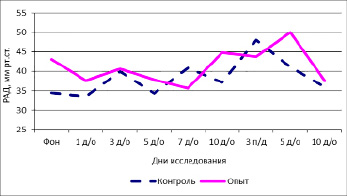
Рис. 2. Динамика РАД под влиянием модельной комбинации частот нейрона
Таблица 3
Изменение вегетативного индекса Кердо под влиянием модельной комбинации частот нейрона
|
Фон |
Дни опыта (воздействия) |
Дни последействия |
|||||||
|
1 |
3 |
5 |
7 |
10 |
3 |
5 |
10 |
||
|
Опыт |
10,84±6,46 |
24,27±6,1 |
16,18±6,24 |
13,62±5,21 |
22,03±2,17 |
11,36±5,64 |
9,04±11,68 |
12,49±7,14 |
7,04±3,41 |
|
Контроль |
19,07±5,33 |
13,6±5,7 |
20,91±3,81 |
16,21±3,009 |
12,4±6,06 |
9,1±3,97 |
28,34±3,34 |
21,32±5,64 |
19,25±3,17 |
Несмотря на кажущуюся нестабильность РАД в группе опыта, на рис. 2 видно, что флуктуации более существенны в группе контроля. Кроме того, сравнение фоновых и конечных значений показывает, что в группе опыта показатель оптимизировался.
Вегетативный тонус означает ту деятельность организма, посредством которой регулируется деятельность всех органов в целях поддержания жизни и уравновешения внешних воздействий. Положительные значения вегетативного индекса Кердо (ВИК) соответствуют преобладанию в организме активности симпатической нервной системы, реализующей функции энергорасхода в организме. Отрицательные значения индекса Кердо соответствуют преобладанию в организме активности парасимпатической нервной системы, реализующей функции энергонакопления в организме и его восстановления. Исследования последних лет подтверждают применимость данного метода на практике [8], за исключением состояний, сопровождающихся стойким повышением артериального давления [9]. Исследование влияния испытуемого фактора на вегетативное равновесие показало, что частотное воздействие может существенно менять ВИК (табл. 3).
Фоновые значения показателя в среднем оказались 19,07±5,33 %, что свидетельствует о выраженной симпатикотонии. В 1-й день опыта индекс существенно не изменился и составил 13,6±5,7 %. К 3, 5 и 7-м дням исследования наблюдалась аналогичная ситуация. Однако к 10-му дню отмечалось некоторое снижение ВИК до 9,1±3,97 %. На 3-й день последействия было отмечено резкое самопроизвольное возрастание значения ВИК до 28,34±3,34 %. В 5-й и 10-й дни последействия ВИК в группе контроля сохранялся на высоком уровне и составил 21,32±5,64 и 19,25±3,17 % соответственно.
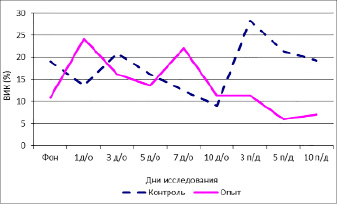
Рис. 3. Изменение вегетативного индекса Кердо под влиянием модельной комбинации частот нейрона
Значения ВИК до начала воздействия в группе опыта составили в среднем 10,84±6,46 %. В 1-й день воздействия отмечалось незначительное нарастание симпатикотонии (13,6±5,7 %). На 7-й день воздействия симпатикотония стала выраженной, и ВИК составил 22,03±2,17 %.
С 10-го дня воздействия отмечалось постепенное снижение исследуемого показателя. К 3-му дню последействия он составил 9,04±11,68 %, а к 10-му дню – 7,04±3,41 %.
Таким образом, в группе контроля, в отсутствие внешних воздействий, происходило нарастание симпатикотонии, а в группе опыта изменения ВИК происходили в сторону нормотонии.
На рис. 3 представлен график изменения вегетативного индекса Кердо под влиянием модельной комбинации частот нейрона.
Видно, что в начале исследования обе группы находились в состоянии симпатикотонии. Направленность изменений в группах противоположна. К концу исследования в группе контроля нарастает симпатикотония, а группа опыта из симпатикотонии переходит в состояние нормотонии. Кроме того, анализ рисунка показывает, что амплитуда флуктуаций в группе контроля значительно выше, чем в опыте.
Заключение
Таким образом, проведенное исследование позволяет заключить, что, моделируя режим работы нейрона в состоянии адаптации, возможно нормализовать физиологические показатели человека. Важно отметить, что данный способ неинвазивен, не вызывает дискомфортных ощущений и заимствует природные частотные сигналы.

