Введение
Поиск новых лекарственных средств связан с моделированием свойств, присущих молекуле с ожидаемыми или заданными параметрами – лекарственными свойствами. Лекарственные свойства определяются как присущие молекуле свойства, которые остаются неотъемлемым элементом исследований по созданию новых лекарственных средств. Оценка структурных характеристик молекулы лекарственного средства, их трехмерной составляющей, с ее прогнозированием имеет решающее значение для успешной разработки будущего лекарства. Биологически активное вещество – лидер, с требуемыми свойствами, подобными лекарственным, может быть преобразовано в качественный препарат-кандидат.
Принцип вычислительных методов QSAR заключается в реализации математической зависимости, количественно связывающей молекулярные дескрипторы с макроскопическими наблюдаемыми (физико-химическими свойствами или биологической активностью) для ряда сходных химических соединений с использованием статистических методов анализа данных.
Молекулярный докинг – это вычислительный инструмент, широко используемый при разработке лекарственных средств на основе структуры для определения сродства связывания и относительной ориентации между белком и лигандом, когда они взаимодействуют друг с другом. Он обеспечивает возможность провести исследование по изучению ингибирующей активности и поиску наилучших соединений с высокой аффинностью и ингибирующей активностью в отношении ряда мишеней, например ацетилхолинэстеразы и бутирилхолинэстеразы, которые являются одними из ключевых мишеней лекарственных препаратов для лечения болезни Альцгеймера [1]. Метод молекулярного докинга моделирует процесс молекулярного распознавания, предсказывая свободную энергию связывания, а также геометрию взаимодействия связанного комплекса «белок – лиганд». Докинг посредством результатов стыковки предсказывает предпочтительную ориентацию (т.е. «наилучшую подгонку» в трехмерном пространстве) лиганда, который связывается с конкретным, представляющим интерес белком.
Цель исследования заключается в корреляционном моделировании дескриптора противовоспалительной активности (ПВА), основанном на молекулярном докинге по интерлейкину 2 в ряду амидов и гидразидов N-ароилантраниловых кислот в оценке биологической мишени.
Материал и методы исследования
Изучение связывания с биологической мишенью противовоспалительной активности – интерлейкин 2 (ИЛ-2) осуществлено AutoDock 4.2. Кристаллографическая копия фермента в формате pdb взята из ресурса RCSB Protein Data Bank: PDB ID code: 1m48 [2]. Статистические исследования, посвященные корреляции, выполнены в программе Statistica 6.
Результаты исследования и их обсуждение
Поиск коррелируемого дескриптора основан на использовании конформации с максимальной энергией молекулярного докинга по ацетилсалициловой кислоте (Be=-5,22 ккал/моль) как исходной точке конструирования соединений анализируемого ряда [3]. Образование связи с ферментом ИЛ-2 происходит в виде комплекса с ацетилсалициловой кислотой по участку связывания (рис. 1).
Сайт связывания активного участка ИЛ-2 состоит из остатков аминокислот цепи А, анализируемой биологической мишени: Лейцин 72 (LEU72A), Валин 69 (VAL62A), Треонин 41 (THR41A) и Аргинин 38 (ARG38A).
Анализируя рисунок 1, можно наблюдать гидрофобные взаимодействия с двумя остатками аминокислот: Лейцин 72 (LEU72A) и Валин 69 (VAL62A). Межмолекулярная водородная связь (ММВС) образуется по О-ацильному заместителю карбонильной группы с аминокислотой Треонин 41 (THR41A). Происходит комбинированное взаимодействие с ММВС и ионизационное, по карбоксильной группе, ацетилсалициловой кислоты с остатком аминокислоты Аргинин 38.
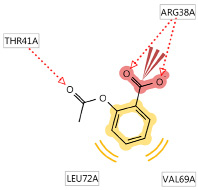
Рис. 1. Диаграмма взаимодействия ацетилсалициловой кислоты с активным участком ИЛ-2
Объектом исследования являются 29 производных антраниловой кислоты под общим химическим названием ряда «амиды и гидразиды N-ароилантраниловых кислот». Общая химическая структура объекта исследования приведена на рисунке 2. Анализируемые производные антраниловой кислоты проявляют широкий спектр фармакологической активности [4, 5].
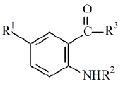
Рис. 2. Общая химическая структура соединений ряда «амиды и гидразиды N-ароилантраниловых кислот» с заместителями: R1, R2, R3
С использованием программы AutoDock 4.2. проведен молекулярный докинг (стыковка) 29 соединений (1–29) общей химической структуры (рис. 2).
Достижения в области вычислительных технологий позволили автору провести виртуальный скрининг, который показал положительное влияние корреляции на процесс обнаружения значимых конформаций ПВА. При виртуальном скрининге применяются стыковка и оценка каждого соединения из набора данных, а используемая методика основана на прогнозировании режимов связывания и сродства к связыванию каждого соединения из набора данных посредством стыковки с рентгеновской кристаллографической структурой ИЛ-2.
Результаты отбора значимых конформации по ИЛ-2: номер конформации, скоринговые функции, остатки аминокислот с водородной связью (Н-связь) и ПВАэксп.
|
№ соединения |
Конформация № |
Н-связь (ИЛ-2) |
BeИЛ-2 |
Ki ИЛ-2, мкмоль |
Ime ИЛ-2 |
RMSD ref |
ПВАэксп., % |
|
1 |
2 |
THR41 |
–4,53 |
479,03 |
–6,02 |
8,13 |
33,60 |
|
2 |
5 |
THR41, ARG38 |
–5,30 |
129,92 |
–6,79 |
3,76 |
66,30 |
|
3 |
1 |
ARG38, LYS43 |
–6,54 |
16,07 |
–8,03 |
4,80 |
59,95 |
|
4 |
1 |
THR41, ARG38 |
–7,01 |
7,32 |
–8,50 |
4,02 |
60,05 |
|
5 |
8 |
нет |
–4,71 |
350,25 |
–6,50 |
5,03 |
–8,10 |
|
6 |
6 |
THR41 |
–5,66 |
71,09 |
–7,15 |
5,06 |
46,40 |
|
7 |
10 |
LYS43 |
–4,85 |
279,68 |
–6,64 |
6,79 |
31,65 |
|
8 |
2 |
ARG38 |
–4,93 |
243,05 |
–5,83 |
3,91 |
19,55 |
|
9 |
2 |
THR41 |
–5,90 |
47,2 |
–6,80 |
4,43 |
36,15 |
|
10 |
8 |
THR41, ARG38 |
–3,44 |
3030 |
–5,82 |
4,49 |
22,70 |
|
11 |
5 |
нет |
–4,30 |
707,21 |
–6,09 |
5,53 |
35,65 |
|
12 |
3 |
ARG38 |
–5,35 |
119,82 |
–6,84 |
5,71 |
42,05 |
|
13 |
1 |
THR41, ARG38 |
–4,89 |
260,04 |
–6,68 |
3,93 |
28,20 |
|
14 |
1 |
THR41 |
–4,90 |
253,88 |
–6,99 |
4,72 |
33,65 |
|
15 |
1 |
THR41, ARG38 |
–6,40 |
20,46 |
–7,29 |
5,04 |
51,50 |
|
16 |
5 |
LEU72 |
–5,72 |
64,51 |
–6,91 |
7,44 |
46,30 |
|
17 |
3 |
LYS43 |
–5,77 |
58,85 |
–6,96 |
5,55 |
46,15 |
|
18 |
8 |
THR41, ARG38 |
–5,25 |
140,77 |
–6,45 |
4,28 |
41,05 |
|
19 |
4 |
THR41 |
–4,34 |
663,56 |
–6,13 |
3,76 |
36,5 |
|
20 |
10 |
ARG38 |
–5,03 |
206,38 |
–6,82 |
5,15 |
21,3 |
|
21 |
6 |
THR41, ARG38 |
–6,86 |
9,35 |
–8,05 |
3,76 |
63,65 |
|
22 |
6 |
THR41, ARG38 |
–7,14 |
5,82 |
–8,63 |
3,90 |
60,25 |
|
23 |
10 |
LEU72 |
–4,01 |
1160 |
–5,80 |
6,03 |
25,10 |
|
24 |
5 |
THR41, ARG38 |
–7,43 |
3,57 |
–8,62 |
4,97 |
55,50 |
|
25 |
8 |
THR41, ARG38 |
–7,04 |
6,88 |
–7,94 |
4,73 |
51,85 |
|
26 |
10 |
ARG38 |
–6,28 |
24,75 |
–7,28 |
4,52 |
32,70 |
|
27 |
5 |
THR41, ARG38 |
–4,70 |
358,36 |
–6,49 |
4,81 |
21,15 |
|
28 |
5 |
THR41, ARG38 |
–7,11 |
6,18 |
–8,40 |
5,58 |
65,65 |
|
29 |
8 |
ARG38 |
–5,85 |
51,37 |
–6,75 |
4,31 |
38,75 |
Исследование молекулярного докинга на основе сетки (Grid анализа), основанное на декартовых координатах, было использовано автором для анализа способов связывания молекул с аминокислотами, присутствующими в активном кармане белка, с координатами центрального участка (x= -4,560, y= 11,693, z= -11,274).
Изучено межмолекулярное взаимодействие анализируемых соединений ряда амидов и гидразидов N-ароилантраниловых кислот молекулярной стыковкой, основанной на 3D-QSAR. Исследование 3D-QSAR было направлено на поиск дескрипторов, которые могут быть соотнесены с ПВА, выраженной в значениях энергий связывания (binding energy (Be ИЛ-2)) с ИЛ-2 (ккал/моль). Для получения дескриптора в исследовании использована линеаризация путем создания линейной зависимости с ПВА. Получение статистически надежной модели во многом зависит от способности дескрипторов, которые являются конечным результатом логической и математической процедуры [6], кодировать вариации активности в соответствии со структурой, а именно дескриптора, связанного с ПВА (BeИЛ-2 ПВА).
Для того чтобы идентифицировать потенциальную модель отбора дескриптора ПВА, проведен анализ результатов докинга 29 соединений производных антраниловой кислоты с активным центром фермента ИЛ-2 с целью изучить взаимодействие соединений производных антраниловой кислоты с 1m48.
Строение проанализированных производных антраниловой кислоты в зависимости от энергии взаимодействия с ИЛ-2 по Be ИЛ-2 приведено на рисунках 3 и 4. Исследование по распознаванию конформаций относительно ПВА выполнено по коэффициенту корреляции, путем отбора результатов, обеспечивающих максимальную линейность (значимых конформаций). Большинство соединений показали хорошие показатели стыковки при взаимодействии с различными аминокислотными остатками (таблица).
Проведен анализ стыковки по ПВА методом корреляционного анализа с помощью программы Statistica 6; среди полученных результатов использованная модель отбора показала высокую корреляцию с коэффициентом корреляции с ПВА, равным 0,730. Результаты корреляционного анализа стыковки с ИЛ-2 приведены в таблице, а модель стыковки в работе описана в виде уравнения простой линейной регрессии: BeИЛ-2 ПВА = – 3,726 – 0,045 × ПВА.
На рисунке 3 приведено строение производных антраниловой кислоты с BeИЛ-2 -6 и менее, обнаруживающих максимальное связывание с ИЛ-2 (9 соединений).
Минимальное связывание с анализируемой мишенью с BeИЛ-2 -5,90 и более обнаружено у 20 соединений, структуры которых приведены на рисунке 4.
Участок связывания амидов и гидразидов N-ароилантраниловых кислот с ИЛ-2 содержит остатки аминокислот: THR41A, ARG38A, LEU72A, LYS43A (таблица).

Рис. 3. Структуры производных антраниловой кислоты с BeИЛ-2 -6 и менее (9 соединений)
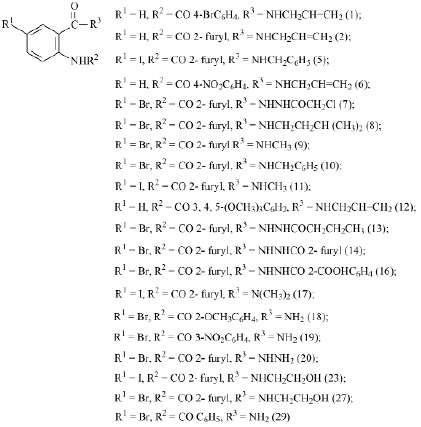
Рис. 4. Структуры производных антраниловой кислоты с Be ИЛ-2 -5,90 и более (20 соединений) с минимальным связыванием с ИЛ-2
Заключение
Проведено исследование 29 производных ряда «амиды и гидразиды N-ароилантра-ниловых кислот» методом молекулярного докинга с ИЛ-2. Получены значения коррелируемого дескриптора противовоспалительной активности (BeИЛ-2 ПВА) с высоким значением коэффициента корреляции, равным 0,730, в оценке правильности выбора биологической мишени.
Корреляционное моделирование дескриптора противовоспалительной активности по ИЛ-2 позволяет не только выделить дескриптор для исследований «структура – ПВА», но и провести оценку биологической мишени на возможность исследования в области поиска модели ПВА для соединений производных антраниловой кислоты.

