Введение
При разработке материалов, предназначенных для восстановления дефектов твердых тканей человека, большое внимание уделяется их составу с точки зрения регулирования сохранности имплантата в организме, возможности и скорости его резорбции, придания необходимых механических свойств, создания пористой структуры. Формирование столь разноплановых характеристик возможно за счет сочетания в одном материале компонентов, различных по своей природе и свойствам. Так, например, смешение фосфатов и силикатов кальция, различающихся между собой величиной произведения растворимости, позволяет получать композиты с варьируемой скоростью растворения [1]. Введение в материал компонентов, выгорающих при прокаливании, обеспечивает появление системы взаимосвязанных открытых пор в структуре продукта [2], что необходимо для успешной остеоинтеграции имплантата в твердую ткань, его долгосрочной физической стабильности. Для модифицирования механических свойств используются добавки полимерных или неорганических волокон, частиц или упрочняющих фаз [3, 4].
Также возможно придание материалам антибактериальных свойств. Данное направление исследований перспективно ввиду стремления к снижению лекарственной нагрузки на организм человека при замещении дефектов, осложненных бактериальной инфекцией. Разрабатываются покрытия на металлических имплантах, керамики, гранулы, включающие антибиотики [5,6,7]. Однако в связи с развивающейся устойчивостью патогенных штаммов бактерий по отношению к известным антимикробным препаратам актуально создание материалов с альтернативными компонентами, проявляющими бактерицидные свойства. К числу последних можно отнести ряд металлов: серебро, цинк, медь, железо и др. [8]. Широко исследуется введение Ag в состав биоматериалов различной природы [9,10]. Перспективно также использование соединений цинка, ввиду его жизненной необходимости для человека. В работе [11] цинк характеризуют как кальций XXI столетия, поскольку данный элемент входит в состав 70 ферментов, включая щелочную фосфатазу, участвует в усвоении силикатов, играет ключевую роль в регуляции гомеостаза костной ткани, ингибирует резорбцию кости остеокластами, стимулирует дифференцировку и пролиферацию клеток, минерализацию кости остеобластами, проявляет антибактериальные свойства.
На основании вышесказанного выполнена серия экспериментов по получению композитных остеопластических материалов в виде полидисперсных образцов гранул, сочетающих фосфат и силикат кальция (биоактивные компоненты) с оксидом цинка, потенциально способным ингибировать рост бактерий. Последнее возможно при условии выделения ионов цинка в среду, окружающую имплант. В этой связи актуально изучение особенностей из деградации в прототипах биологических жидкостей.
Цель данной работы – исследование динамики деградации сферических пористых гранул, включающих фосфат кальция (гидроксиапатит, ГА, Са10(РО4)6(ОН)2), силикат кальция (волластонит, ВТ, β-СаSiO3), желатин и варьируемое количество оксида цинка (ZnO).
Материалы и методы исследования
Экспериментальные образцы гранул получены по суспензионной технологии с использованием композитного порошка, включающего 60 мас. % Са10(РО4)6(ОН)2 и 40 мас. % β-СаSiO3, синтезированного согласно патенту РФ № 2657817, и порошка оксида цинка, осажденного щелочью из водного раствора ZnCl2 и просушенного на воздухе при 300°С. Минеральная составляющая гранул включала 5, 10, 15, 20 или 25 мас.% ZnO. Согласно данным физико-химических исследований образцы имеют пористую структуру, открытую пористость до 60 %, истинную плотность в районе 2.5 г/см3.
В ходе эксперимента оценивали набухание гранул (изменение их размеров и массы) при выдерживании в Трис-буфере с рН = 7.40, как описано в работе [12].
Динамику растворения гранул изучали по изменению рН раствора и концентрации в нем ионов кальция и цинка. Соотношение массы частиц к объему Трис-буфера составляло 1:2. Каждые сутки из системы отбирали порцию раствора для анализа. рН измеряли на рН-метре «рН-150МИ», укомплектованном электродом «ЭСК-10314/7» (Измерительная техника). Концентрации ионов Са2+ и Zn2+ в растворах определяли спектрофотометрическим методом по интенсивности окраски раствора Арсеназо III и сульфарсазена, соответственно. Все эксперименты проведены в статичных условиях при температуре 22 ± 2 °С в трехкратной повторности.
Гранулы исследовали на микроскопе «Микромед 3 (вар. 3-20М)» (Наблюдательные приборы), оснащенном видеокамерой и программой «ToupView» для обработки изображений. Также выполнен анализ материалов с применением ИК-Фурье-спектроскопии на ИК-спектрометре «ФТ-801» с ПО «ZаIR 3.5» (Симекс) и сканирующей электронной микроскопии на электронном микроскопе «JCM-5700» (JEOL).

Рис. 1. Фотографии гранул, содержащих 15 мас.% ZnO (а, б) и 25 мас.% ZnO (в, г) до (а, в) и после (б, г) выдерживания в Трис-буфере в течение 1 суток
Результаты исследования и их обсуждение
Установлено, что при выдерживании гранул в Трис-буфере происходит их набухание. Частицы увеличиваются в диаметре до 20% за счет набухания связующего (рис. 1). Также во времени растет масса материалов (рис. 2а). Наибольший прирост происходит в первый час контакта частей системы. Очевидно, это связано с заполнением жидкой фазой пор во внутренней структуре частиц и гидратацией желатина. Степень набухания (S) для всех образцов через 7 ч слабо изменяется. Вероятно, в данный период завершается формирование на поверхности гранул гидратированного слоя и начинается активный ионный обмен между твердой фазой и раствором. Об этом свидетельствует резкое повышение рН системы на начальном этапе эксперимента и появление в растворах ионов кальция и цинка (рис. 2б-г).
Установлено отсутствие достоверного различия зафиксированных значений рН и концентрации ионов кальция и цинка в растворах, контактировавших с образцами с варьируемым содержанием ZnO (рис. 2б-г). При этом величина рН и концентрация ионов Са2+ изменяются схожим образом: на зависимостях рН = f(t) и C(Ca2+) = f(t) виден резкий скачок измеряемых параметров через 1 сутки контакта гранул всех изучаемых составов с Трис-буфером, далее до 10 суток водородный показатель и количество кальция в среде быстро падают, после 10-ти суток оба показателя медленно снижаются. Вероятно, это связано с быстрой гидратацией поверхности и компонентов гранул, протекающей со связыванием протонов из среды и их обменом на кальций из состава Са10(РО4)6(ОН)2 и β-СаSiO3. Наблюдаемое в дальнейшем снижение рН и количества ионов кальция в системах может быть связано с протеканием процессов вторичной кристаллизации аморфного фосфата кальция в щелочной среде.
По рис. 2г видно, что концентрация ионов цинка в растворах монотонно увеличивается на всем протяжении эксперимента. Хотя достоверного различия между значениями концентрации Zn2+ в растворах, контактировавших с образцами с варьируемым содержанием ZnO, не выявлено, можно отметить, что количество ионов цинка в системах с гранулами, содержащими 25 мас.% ZnO, превышает таковое для гранул с 5 мас.% ZnO на 5 – 20 мкмоль/л. По окончании эксперимента, через 60 дней контакта материалов с 25 мас.% ZnO с Трис-буфером в растворах содержится до 83 мкмоль/л Zn2+, что соответствует растворению примерно 10% цинка от его исходного содержания в гранулах.
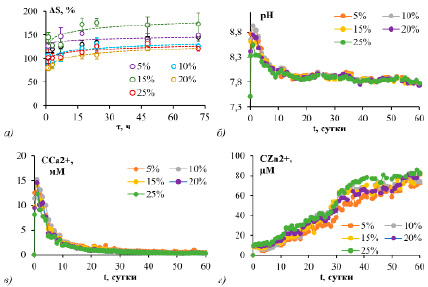
Рис. 2. Зависимости степени набухания гранул (а), рН (б), концентрации ионов кальция (в) и цинка (г) в растворах от содержания ZnO в материалах
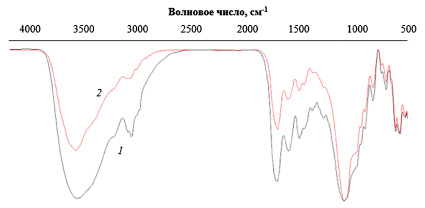
Рис. 3. ИК-спектры гранул, содержащих 25 мас.% ZnO, в исходном состоянии (1) и после 28 суток выдерживания в Трис-буфере (2)
Результаты исследования методом ИК-Фурье-спектроскопии образцов, контактировавших с Трис-буфером в течение 28 суток, указывают на то, что наряду с минеральными компонентами гранул также растворяется желатин (связующее). По рис. 3 заметно снижение интенсивности полос колебаний функциональных группировок, входящих в состав желатина, расположенных в областях 1200 – 1600 см-1 и 2700 – 3000 см-1. О неполном удалении связующего из состава материалов за указанный период также свидетельствует сохранность сферической формы гранул, наблюдающаяся в эксперименте (рис. 4).
В ИК-спектрах гранул, контактировавших с Трис-буфером, не отмечено колебаний, не относящихся к исходным компонентам гранул. Спектры образцов в исходном состоянии и после 28 суток выдерживания в модельном растворе характеризуются набором полос поглощения группировок, входящих в состав гидроксиапатита (563, 603, 630, 962, 1026, 1087 см-1 [13]), волластонита (568, 647, 684, 828, 905, 935, 968, 1020, 1063, 1200 (плечо) см-1 [14]) и желатина (оксид цинка не имеет собственных полос поглощения в области 500 – 4000 см-1). Это позволяет сделать вывод о неизменности качественного состава основного объема гранул. При этом заметно снижение интенсивности полос поглощения группировок Si-O, образующих β-СаSiO3, по истечении 4 недель контакта с водной средой. Очевидно, это связано с большей растворимостью фазы силиката кальция в сравнении с апатитом.
а) 
б) 
Рис. 4. Микрофотографии гранул, содержащих 25 мас.% ZnO, в исходном состоянии (а) и после 28 суток выдерживания в Трис-буфере (б)
На рис. 4 представлены микрофотографии гранул исходном состоянии и после 28 суток выдерживания в Трис-буфере. Видно, что после контакта с водной средой на поверхности сфер появляется большое число пор с диаметром от единиц до нескольких десятков микрометров, гранулы становятся более пористыми. Таким образом, результаты исследования материалов методом сканирующей электронной микроскопии также указывают на постепенное преобразование композитных частиц в результате растворения входящих в их состав компонентов.
Заключение
По результатам выполненного исследования установлено, что синтетические пористые композитные гранулы, сочетающие в своем составе фосфат кальция (гидроксиапатит), силикат кальция (волластонит), желатин и оксид цинка (до 25 мас.%), постепенно деградируют в водном слабощелочном растворе. При этом растворяются все компоненты материалов. Ионы цинка длительно монотонно выделяются в окружающую среду, что может обеспечить устойчивый антибактериальный эффект при имплантации гранул в место инфицированного костного дефекта. При этом варьирование количества ZnO в составе материалов, вероятно, позволит регулировать длительность растворения данной добавки и, соответственно, период противомикробного действия имплантата.

