Введение
Бактерия Aeromonas salmonicida представляет собой один из самых интересных объектов микробиологических исследований, особенно в контексте аквакультуры и рыбоводства. Эта патогенная бактерия вызывает заболевание, известное как септицемия, у рыб, в частности у лососевых, что приводит к значительным экономическим потерям для рыбоводов [1]. Проникновение и колонизация Aeromonas salmonicida в организме хозяина сопровождаются сложными патогенетическими механизмами, включая выработку экзотоксинов и ферментов, способствующих разрушению тканей. Интерес к этой бактерии также обусловлен ее способностью выживать в различных экологических условиях. Так, способность Aeromonas salmonicida к анаэробному и аэробному дыханию позволяет ей обитать в различных субстратах от кислородонасыщенных пресных водоемов до глубоких анаэробных карманов [2]. Ключевым фактором является ее способность к метаболизму углеводов и белков. Aeromonas salmonicida использует глюкозу и другие сахара как основной источник энергии, однако в условиях недостатка олигоэлементов она может переходить на расщепление аминокислот, что делает ее метаболизм весьма гибким [3]. С точки зрения физиологии эта бактерия обладает высокоразвитыми системами транспортировки питательных веществ, позволяющими эффективно усваивать микроэлементы, необходимые для ее жизнедеятельности [4]. Также она вырабатывает ряд ферментов, способствующих разрушению органических веществ в окружающей среде. Таким образом, разнообразные механизмы метаболизма Aeromonas salmonicida дают ей конкурентное преимущество в среде обитания, обеспечивая выживаемость и патогенность в отношении рыб.
Изучение белка АТФ-зависимой ДНК-геликазы бактерии Aeromonas salmonicida представляет собой значимый шаг в понимании молекулярных механизмов, обеспечивающих жизнедеятельность микроорганизмов. Эта геликаза играет ключевую роль в репликации и ремонте ДНК, что является критически важным для поддержания генетической стабильности и адаптации к стрессовым условиям окружающей среды [5]. Исследование структуры и функции АТФ-зависимой ДНК-геликазы может раскрыть молекулярные механизмы, стоящие за патогенностью бактерии. Понимание этих процессов поможет в разработке новых подходов к лечению инфекций, вызываемых этой и подобными бактериями. Кроме того, белки, задействованные в механизмах репликации и ремонте ДНК, служат потенциальными мишенями для антимикробных агентов [1]. Таким образом, изучение данного белка не только углубляет научные знания о молекулярных функциях, но и открывает новые горизонты для медицины и биотехнологии, что делает эту тему исключительно актуальной и многогранной.
Изучение генетических особенностей данной бактерии открывает перспективы для разработки новых методов диагностики и лечения инфекций, вызываемых ей. В свете глобального потепления и изменения экосистем эта бактерия становится объектом пристального внимания, поскольку ее появление может влиять на экосистему и здоровье водных организмов в целом [6].
Молекулярное моделирование структурообразования белковых молекул и их ассоциатов позволяет определять специфику их физико-химических и молекулярно-биологических свойств, а также процессов, протекающих с их участием [7]. Изучение пространственной структуры ДНК-геликазы бактерий является ключевым аспектом молекулярной биологии, имеющим важные биотехнологические приложения [8].
Пространственная структура геликаз раскрывает ряд важных деталей взаимодействия между белками и нуклеиновыми кислотами, что позволяет построить более точные модели их функциональности. Изучение вариаций этих ферментов у различных бактерий может также объяснить их устойчивость к антибактериальным препаратам. Обладая знаниями о структурной организации, исследователи могут прогнозировать свойства новых геликаз и разрабатывать подходы для инженерии ферментов с улучшенными характеристиками [9]. Таким образом, исследование пространственной структуры ДНК-геликазы – это не просто научный интерес, а необходимый шаг для продвинутых исследований в области медицины и биотехнологий. Интерес к структуре гликозидазы бактерий обусловлен, в частности, задачами пищевой биотехнологии, связанными с процессом расщепления крахмала при получении продукции [10].
Цель исследования – построить модель третичной структуры белка модифицированной на участке аминокислотной последовательности АТФ-зависимой ДНК-геликазы гетеротрофной грамотрицательной бактерии Aeromonas salmonicida.
Для достижения поставленной цели решены следующие задачи:
а) внесены модификационные изменения в fasta-файл, описывающий первичную структуру белка;
б) на основе сгенерированной первичной структуры модифицированного белка получено изображение 3D-структуры модифицированной АТФ-зависимой ДНК-геликазы;
в) рассчитаны структурно-динамические характеристики глобулярной структуры исследуемого белка.
Материалы и методы исследования
Файл Fasta исходного немодифицированного белка получен с помощью ресурса с открытым доступом [11]. В этот файл внесено изменение, отражающее модификацию в конечной части аминокислотной последовательности путем замены фрагмента LRALFKKD на DGEIFTET (рис. 1). Полученные данные были обработаны в программе Swiss-model, предназначенной для моделирования структуры трехмерных белковых молекул, построенной на основе нейронной сети для расчета геометрии молекул и структурных свойств биоорганических соединений. Эта программа использует подход, основанный на гомологии, определяющей структуру белка на основе известных структур схожих белков. Этот метод основан на предположении, что белки с похожей аминокислотной последовательностью будут иметь схожие трехмерные структуры.
Составленная авторами схема третичной структуры белка представлена на рис. 2. Гидрофобные участки молекулы окрашены в синий цвет, гидрофильные – в красный.
Геометрия изучаемого модифицированного белка оптимизировалась в соответствии со структурой белка, обладающего наибольшим значением фактора GMQE (Global Model Quality Estimation), отражающего ожидаемое качество модели и учитывающее выравнивание мишени с моделью и покрытие мишени моделью.
Структурным прототипом изучаемого белка являлся белок 1uaa.1B из банка данных трехмерных структур белков и нуклеиновых кислот PDB со значением GMQE = 0,90.
Результаты исследования и их обсуждение
Авторами составлена и проанализирована схема третичной структуры рассматриваемого белка (рис. 2) с помощью ресурса Swiss-model [12]. Достоверность структуры была оценена с помощью подхода Local Quality Estimate, который анализирует качество модели по отдельным аминокислотным остаткам или небольшим регионам белковой структуры.

Рис. 1. Модификация fasta-файла АТФ-зависимой ДНК-геликазы бактерии Aeromonas salmonicida
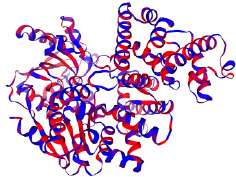
Рис. 2. Третичная структура исследуемого белка
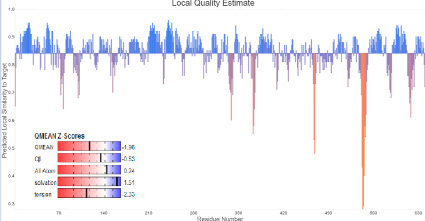
Рис. 3. Результаты оценки структурных данных изучаемого белка в Swiss-model
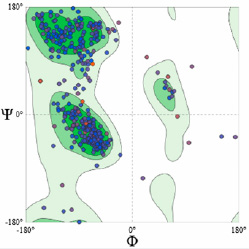
Рис. 4. Карта Рамачандрана модифицированной АТФ-зависимой ДНК-геликазы
При этом для оценки качества трехмерной модели модифицированной АТФ-зависимой ДНК-геликазы был использован инструмент оценки структуры (Structure Assessment) программы Swiss-model для вычисления показателя QMEANDisCo [13]. Этот показатель получен путем анализа попарных расстояний между остатками с учетом пространственных ограничений.
Также были определены потенциалы взаимодействия на уровне атомов Cβ (Cβ) и всех атомов (All Atom), определен коэффициент сольватации (Solvation) и установлены диапазоны изменений торсионных углов для трех последовательных аминокислот (Torsion). Вычисленные параметры структуры модифицированного белка были обобщены с помощью показателя геометрии структуры QMEAN. Согласно результатам оценки структуры, модель, разработанная с использованием Swiss-model, является наиболее удачной. При этом идентичность модели по отношению к гомологичным белкам составила 74,42 %. Показатель QMEANDisCo, являющийся комплексной метрикой, дает возможность детально оценить точность и качество созданной модели белка. Он удобно интегрирует несколько аспектов структурной информации, чтобы обеспечить целостное понимание пространственной организации белка. Для этой модели торами на базе ресурса [12] был получен график (рис. 3) оценки локального качества каждого аминокислотного остатка. Отклонения для каждого остатка от глобального значения QMEANDisCo в большую (синий) или меньшую (красный) сторону продемонстрированы вертикальными линиями. Принято считать, что остаткам со значением ниже 0,6 соответствует низкое качество структуры. На основе полученных данных авторами составлена карта Рамачандрана с разрешением 2,5 Å (рис. 4). Структура модифицированного белка интерпретирована с позиций филогенетического ряда, основанного на определенной последовательности фруктозы и бисфосфатальдолазы.
В этом семействе белков наблюдаются димерные структуры. Авторами оценены вклады каждой из структур (рис. 5, а). Димерные структуры, иллюстрируемые на диаграммах синим цветом, подчеркивают мономерные полипептидные системы, важные для межмолекулярных взаимодействий. Зеленая кривая соответствует присутствию гомодимерной молекулярной системы, состоящей из двух одинаковых белковых молекул.
С увеличением оценки Z-score QMEAN возрастает согласие между модельной структурой и структурами аналогичного размера. Более высокие значения Z-score QMEAN свидетельствуют о лучшем соответствии между модельной структурой и экспериментальными конструкциями аналогичного размера. Если показатель ниже -4.0, это указывает на модели с очень низким качеством. Следовательно, разработанная модель обладает высоким уровнем качества (рис. 5, б). Полученные авторами с помощью ресурса [12] значения структурных характеристик исследуемого белка представлены в таблице.
Рис. 5. Результаты метода PPI Fingerprint для структуры модифицированной гликозидазы (а); оценка качества модели (б)
Рассчитанные структурные характеристики белка
|
Показатель |
Комментарий |
Значение (расчет/норматив) |
|
MolProbity Score |
Кристаллографическое разрешение белка |
2,50 |
|
Clash Score |
Перекрытие сферы Ван дер Ваальса > 0,4 Å |
3,96 |
|
Ramachandran Favoured |
Участок карты Рамачандрана в районе, занимаемом ≥ 98 % от статистики Рамачандрана |
90,91 % / ≥ 98 % |
|
Ramachandran Outliers |
Участок карты Рамачандрана в районе, занимаемом ≤ 0,05 % от статистики Рамачандрана |
2,35 % / ≤ 0,05 % |
|
Rotamer Outliers |
Маловероятные конформации с учетом статистики ротамеров ≤ 0,3 % |
11,27%/≤ 0.3% |
|
C-Beta Deviations |
Отклонение положения атомов Cβ от идеального на > 0,25 Å |
12/0 |
Заключение
Таким образом, использование инструмента оценки структуры Swiss-model и показателя QMEANDisCo позволило проанализировать модифицированную модель белка АТФ-зависимой ДНК-геликазы бактерии Aeromonas salmonicida и оценить ее качество с учетом различных структурных параметров. Полученные результаты, включая визуализацию 3D-структуры и расчеты геометрических и структурно-динамических параметров, могут служить основой для более глубокого понимания механизмов действия модифицированного белка.
Значимость димерных структур в рассматриваемом семействе белков подтверждает важность межмолекулярных взаимодействий в обеспечении структурной стабильности и функциональности. Мономерные и гомодимерные системы, проиллюстрированные графически, подчеркивают критическую роль взаимодействий на уровне отдельных молекул и их надмолекулярных сборок в жизнедеятельности белков. Данные исследования актуальны для дальнейшего изучения и модификации белковых структур, потенциально предлагая инновационные подходы для биоинженерии и биотехнологии. Качество модели, подтвержденное количественными оценками GMQE иQMEAN, указывает на ее надежность и возможность для дальнейшего применения в контексте эволюционной биологии.

