Введение
В последнее время значительное внимание уделяется разработке твердых полимерных электролитов, основанных на органо-неорганических материалах, полученных путем комбинации ионов металлов с многофункциональными органическими анионами, образующими внутреннюю сферу. Данные материалы перспективны при создании электрохимической ячейки с твердофазным электролитом, применяемой не только в химических источниках тока, но и при работе электрохромных устройств. Электрохромные материалы могут быть использованы в комплектующих материалах систем отображения информации с малым энергопотреблением, в областях, где требуется модуляция электромагнитного излучения за счет возможности переключения ячейки (окрашивания/обесцвечивания) [1]. Применение электролитов, основанных на металлорганических каркасах, является перспективным направлением в электрохимии. Органо-неорганические материалы обладают развитой поверхностью, имеют простую модификационную структуру, определенный тип кристаллической решетки, что оказывает влияние не только на процесс диссоциации, но и на стабильность соединения. Для неорганических твердотельных электролитов основными характеристиками являются: высокая величина ионной проводимости, твердая механическая основа и химическая стабильность, в то время как органические твердотельные электролиты (или твердые полимерные электролиты) могут изготавливаться разных размеров, вплоть до пленок, и за счет химических характеристик обладать повышенной гибкостью. Недостатками являются: слабая контактная граница в системе электрод/электролит и плохо выраженная способность органических твердых электролитов к ионной проводимости [2]. Авторами предлагается использовать комплексное соединение, в состав которого входят борная, лимонная кислоты и катионы двухвалентной меди (Cu+2) для создания электрохимической ячейки. Физические и электрохимические свойства нового композита сравнивались с ранее изученным органо-неорганическим полимерным материалом на основе перфторированных сульфокислот сульфосалицилатом Fe3+.
Целью исследования является разработка методики синтеза гибридного органо-неорганического твердого электролитана на основе лимонной, борной кислот и катионов двухвалентной меди; изучение электрохимических и проводниковых свойств комплексного соединения от изменения концентрации ионов меди.
Материалы и методы исследования
Использованы реактивы: борная кислота «ХЧ», лимонная кислота безводная «ЧДА», порошок CuO (II) 99,99 % ОСЧ 9–2. Методика получения нового органо-неорганического твердотельного электролита основана на двухступенчатом синтезе комплексного соединения.
Первично идет формирование внутренней сферы комплекса на основе борной и лимонной кислот. Молярные соотношения соединений составляют 0,5 моль к 1 молю соответственно. Смешивание борной и лимонной кислот производится в холодной воде при постоянном перемешивании в течение 15 мин, затем раствор помещают на водяную баню, температуру увеличивают постепенно до 73–75ºС. Нагрев смеси продолжается до полного растворения кислот, после смесь ставится на кристаллизацию в эксикатор при комнатной температуре. Процесс кристаллизации проходит в течение двух суток, затем кристаллы отделяют от маточного раствора, сушат и повторно растворяют в воде.
Вторым этапом является формирование внешней сферы, в состав которой входят ионы двухвалентной меди. Порошок оксида меди берется в разных концентрациях от 0,005 до 2 М, добавляется в раствор постепенно при постоянном перемешивании. Готовится несколько образцов комплексной соли с разными молярными соотношениями внешней и внутренней сфер. Смеси ставятся повторно на водяную баню при температуре не ниже 65 ºС, где в течение суток происходит выпадение кристаллов комплексного соединения, содержащего во внешней сфере ионы двухвалентной меди. Осадок формируется около 5–6 дней, после чего фильтруется и высушивается. Выход продукта составил от 73 до 79 %. Полученные кристаллические комплексные соединения хорошо растворимы в перекиси водорода, воде, плохо растворимы в органических растворителях. Используя сертифицированное оборудование, в частности потенциостат PAR273A, гальваностат и спектрофотометр Perkin Elmer Lambda19 UV/Vis/NIR, были сняты спектры исследуемых образцов, при этом использованы кварцевые кюветы с оптическим трактом (OP) 10 мм. Было определено, что изменение концентрации непосредственно оказывает влияние на электрохимические характеристики электролитов. Процент поглощения был рассчитан путем вычитания минимального значения из полученных значений поглощения и деления на его максимальный параметр. Рабочий электрод был представлен платиновой сеткой Pt (WE, 0,691 см2), вторым электродом являлся электрод сравнения Ag/AgCl (RE, ALS, Япония). Необходимым условием является деаэрация, которую проводили в течение 15 мин в аргоне, используя герметичную кювету. Для изучения электрохимических характеристик синтезированных комплексов, отличающихся концентрацией ионов меди во внешней сфере, использовали метод деконволюции УФ/ВИД спектров. Были сняты поверхностные СЭМ-изображения матрицы твердофазного электролита с использованием поляризационного микроскопа ZEISS AXIO Scope A1 в проходящем свете по программе Axio Vision Rel 4.8. Определение термической стабильности комплексов проводили на синхронном термоанализаторе NETZSCH STA-449 F1Jupiter. Диапазон температур брался в интервале от 20 до 950ºС, в качестве среды использовался чистый аргон.
Результаты исследования и их обсуждение
Для синтеза комплексного твердого электролита использовались катионы двухвалентной меди разных концентраций, получены соответствующие образцы комплексных соединений. Образцы органо-неорганического комплекса имеют выраженные отличия в спектрах поглощения, что косвенно доказывает изменения в молекулярной структуре соединений. Подобные особенности строения сказываются на свойствах твердотельного электролита. На спектрах видна область перехода от комплексообразователя к иону металла, в частности координация ионов двухвалентной меди определяется диапазоном от 220 до 390 нм. Прослеживается выраженная зонная структура, на которую влияет степень комплексообразования катиона [3]. Первоначально определенная область поглощения используется в качестве сравнения при определении состава ацидокомплексов бора с разной концентрацией катионов меди (рис. 1). В частности, наличие полосы поглощения в области 210–260 и 340–420 нм соответственно является доказательством данного предположения.
При концентрации ионов меди 2 М наблюдается дополнительно малая полоса на длине волны 384 нм, отсутствующая у других изучаемых соединений. Согласно [4] образование высококоординированных комплексов меди определяют по наличию полос на длинах волн 273 нм или 384 нм, что позволяет сделать предварительный вывод о зависимости координации ионов меди в комплексных соединениях от их концентрации.
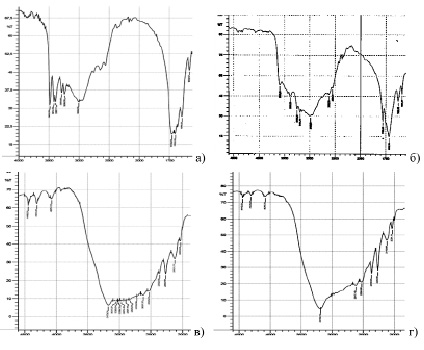
Рис. 1. Графическое изображение ИК-спектров комплексного твердофазного электролита с разной концентрацией ионов меди: а) концентрация 5 мМ, б) концентрация 50 мМ, в) концентрация 0,5 М, г) концентрация 2 М
Зависимость изменения электрохимических показателей от концентрации ионов меди в твердом электролите
|
Концентрация Cu2+, М |
E,V и Ag/AgCl |
E,V и Ag/AgCl |
ΔE, V |
i, мА, см-2 |
D, см2 s-1 |
|
0,005 |
0,404 |
0.355 |
0.049 |
1,02 |
1,7·10-5 |
|
0,05 |
0,427 |
0.334 |
0.093 |
2,14 |
2,9·10-5 |
|
0,5 |
0,420 |
0.340 |
0.080 |
2,50 |
7,8·10-5 |
|
2 |
0,419 |
0.305 |
0.114 |
1,68 |
0,7·10-6 |
|
Сульфосалицилат Fe3+ |
0,390 |
0,303 |
0,087 |
1,17 |
1,55·10-5 |
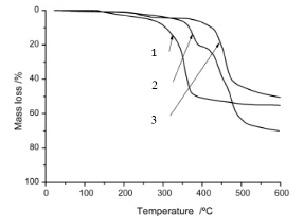
Рис. 2. Графическое изображение ТГ-кривых органо-неорганических комплексов в атмосфере аргона: 1 – концентрация ионов меди 50 мМ, 2 – концентрация ионов меди 0,5 М, 3 – концентрация ионов меди 2 М
Раствор с минимальной концентрацией ионов меди (5 мМ) имеет максимум при 930 нм, увеличение концентрации сдвигает диапазон в область 920 нм. Изменение концентраций ионов меди от 0,005 до 2 М при синтезе электролитов оказывает влияние на разницу потенциалов анодного и катодного процессов. Установлено, что плотность тока увеличивается с повышением концентрации активных веществ, а также значения потенциалов увеличиваются от 0,36 до 0,48 В. Сравнение показателей проводили с гибридным органо-неорганическим полимерным материалом на основе перфторированных сульфокислот сульфосалицилатом Fe3+. Взаимосвязь процесса растворимости и коэффициента диффузии с изменением концентрации ионов меди в составе твердого электролита показана в таблице.
Известно, что включение в состав комплекса ионов металлов d-элементов усиливает ион-дипольные взаимодействия между ионами внешней сферы и диполями внутренней сферы комплекса [5], что можно непосредственно наблюдать при включении ионов меди во внешнюю сферу комплексного соединения на основе борной и лимонной кислот. Используя термогравиметрический (ТГ) анализ гибридных органо-неорганических комплексов, определяли момент начала термической деструкции комплексов. Спектры сняты в атмосфере аргона. На рис. 2 показаны графические изображения ТГ-кривых органо-неорганических комплексных соединений, образованных с разной концентрацией ионов меди при формировании внешней сферы. Разложение начинает происходить при 250, 328 и 350 ºC для комплексов с концентрацией ионов меди 50 мМ, 0,5 М и 2 М соответственно, что позволяет сделать вывод об отсутствии кристаллизационной воды в структуре молекул.

Рис. 3. Изображение сферолитов на матрице твердофазного электролита при разных концентрациях ионов меди: а) 5 мМ , б) 50 мМ, с) 0,5 М, д) 2 М
Отсутствие кристаллизационной воды положительно сказывается на электрохимической стабильности электролитов [6]. Дальнейшие исследования показали, что увеличение концентрации ионов меди не менее 2 М расширяет окно электрохимической стабильности комплексных солей на основе органо-неорганической внутренней сферы. Комплекс с концентрацией соли 5 мМ разложился при температуре 120ºС, в его состав входит кристаллизационная вода, что приводит к ослаблению термостойкости соединения.
Изменение температуры до 400ºС приводит к полному разложению внутренней сферы комплекса с концентрацией ионов меди 50 мМ, при 456ºС наблюдается деструкция комплекса с концентрацией ионов меди 0,5 М, и при 512ºС разрушается комплекс с концентрацией ионов меди 2 М. Экзотермические пики слабо выражены у всех комплексов, уменьшение массы продуктов составило от 13 до 24 %. Таким образом, среди четырех солей высокая термическая стабильность наблюдается у соединения с максимальной концентрацией ионов меди. Согласно [6], термостойкость зависит от сопряженных энергий между анионом внутренней сферы и катионом внешней сферы, увеличение сопряжения усиливает прочность комплекса.
Используя СЭМ-изображения матрицы изучаемых электролитов, удалось зафиксировать процесс зародышеобразования. На рис. 3 показан процесс формирования мелких сферолитов, возникающих при высоких концентрациях ионов двухвалентной меди, что приводит к ускорению процесса зародышеобразования и формированию кристаллической структуры. Известно, что формирование сферолитов увеличивает проводимость твердофазного электролита [6]. Появление сферолитов способствует более плотному взаимодействию между электродом и твердым электролитом. При возникновении полярных взаимодействий на границе раздела фаз, связанной с увеличением концентрации ионов меди во внешней сфере гибридного органо-неорганического комплексного твердофазного электролита наблюдается выраженное перемещение сферолитов к поверхности образца.
Используя метод инфракрасной спектроскопии, можно предположить взаимосвязь кинетических характеристик комплексных соединений от концентраций ионов d-элементов [7]. Наличие полос в области 840 и 1284 см-1 наблюдается только в тех образцах, где имеются сферолиты. Образец с наименьшей концентрацией ионов меди при кристаллизации образует полярную β-фазу. Изменение концентрации Cu (II) в образцах приводит к значительному уменьшению данной фазы в образующихся кристаллах твердого электролита. Согласно [7] прочность химической связи между внутренней сферой комплекса и внешней сферой, образованной d-элементами, определяется полосами в области 1130–1351 см-1. Обнаружение пиков валентных колебаний в области 740, 1132 и 1349 см-1 в образцах с концентрацией ионов меди 2 М служит дополнительным доказательством уменьшения влияния катиона меди на внутреннюю сферу комплекса, что приводит к изменению прочности химической связи всего соединения. Проводимость изучаемых комплексов сравнивали с ранее полученными полимерными электролитами на основе перфторированных сульфокислот, значение ионной проводимости которых изменялось в диапазоне от 10-5 до 10-4 См·см-1. Изменение концентрации ионов меди приводит к ослаблению взаимодействия внешней и внутренней сфер, что объясняет увеличение показателей диэлектрической проницаемости и модуля Юнга [7]. Наблюдается изменение значения ионной силы в пределах от 2,3 × 10-5 S до 1,4 × 10-4 S см-1, что вызывает колебания электрохимической стабильности от 0 до 3,5 В.
Заключение
Синтезирован органо-неорганический композит, в состав внешней сферы которого входят ионы двухвалентной меди, а внутренняя сфера образована борной и лимонной кислотами. Предлагаемое комплексное соединение может быть отнесено к группе органо-неорганических твердых электролитов. Доказано, что при концентрации ионов меди не менее 2 М в комплексах наблюдается максимальная координация ионов. Высококоординированные электролиты являются наиболее перспективным материалом в электрохимии. Доказано влияние концентрации ионов Cu (II) на структуру, ионную проводимость, термическую стабильность, прочность химических связей и процесс зародышеобразования. Определены коэффициенты диффузии ионов двухвалентной меди, доказана их зависимость от концентрации. Для исследования поверхности гибридного электролита был использован метод сканирующей электронной микроскопии. На СЭМ-изображениях матрицы органо-неорганических электролитов, полученных при избытке катионов меди, зафиксирован процесс зародышеобразования. Наличие большого количества сферолитов вызывает ослабление ион-дипольных взаимодействий, увеличивает значения показателей ионной проводимости. Физические и электрохимические свойства нового композита сравнивались с ранее изученным органо-неорганическим полимерным материалом на основе перфторированных сульфокислот сульфосалицилатом Fe3+. Используя термогравиметрический (ТГ) анализ, определили момент начала термической деструкции комплексов. Доказано, что среди четырех солей высокая термическая стабильность наблюдается у соединения с максимальной концентрацией ионов меди. Данный комплекс обладает выраженной термической стабильностью, высокой ионной проводимостью, широким диапазоном рабочих потенциалов до 3,5. Методика синтеза нового электролита довольно проста по сравнению с известными композитами и не требует значительных финансовых затрат. Электролит может быть рекомендован в качестве материала для электрохимической ячейки при работе химических источников тока. Дополнительно его можно использовать как электрохромный материал, применяемый для затемнения стекол, зеркал, оптического оборудования или в системах отображения информации с малым энергопотреблением.

