Введение
Одним из наиболее крупных по видовому и формовому разнообразию среди древесно-кустарниковых растений является род боярышник (Crataegus L.) семейства Rosaceae. Представители этого рода с давних пор являлись объектами интродукции во многих ботанических садах, в том числе и в России [1, с. 120–121; 2; 3].
Препараты из растения рода боярышник (Crataegus L.) применяют как кардиотоническое и регулирующее кровообращение средство при сердцебиениях, бессоннице, повышенном артериальном давлении; эти средства не кумулируются в организме, не вызывают привыкания, мягко действуют [4, 5, 6].
В Государственную фармакопею Российской Федерации XV издания (ГФ РФ XV) (ФС.2.5.0061) включено 14 видов боярышника [7], но на территории России не все эти виды обладают большой сырьевой базой. Таким образом, ввиду потребности в сырье и с целью уменьшения экологической нагрузки на официнальные виды боярышника является актуальным изучение близкородственных им видов.
Изучаемые авторами виды введены в культуру Сибирским ботаническим садом Томского государственного университета в 1980-е годы. Эти североамериканские виды используют в декоративном садоводстве. Они высокозимостойки, засухоустойчивы, нетребовательны к почвам, декоративны в течение всего периода вегетации благодаря изящным листьям, окрашивающимся осенью в оранжево-красные тона, многочисленным белым цветкам в щитковидных соцветиях, крупным, многочисленным плодам яркой окраски, украшающим крону в течение двух месяцев. Высокая побегообразовательная способность может сохраняться до 150 лет. Эти виды боярышника являются перспективными объектами для изучения.
Одной из актуальных задач современной фармации являются поиск и исследование перспективных природных источников веществ, обладающих антирадикальной и антиоксидантной активностями [8, 9, 10]. Известно, что высокой антиоксидантной активностью обладают растительные полифенолы [11]. Поэтому антиоксидантная терапия предусматривает потребление природных антиоксидантов в определенном количестве и применение лекарственных препаратов, полученных на основе лекарственных растений.
Цель исследования: изучение химического состава и антиоксидантной активности плодов и листьев пяти малоизученных североамериканских видов боярышника, культивируемых в Западной Сибири.
Материал и методы исследования
Объектами исследования служили североамериканские видов боярышника: Crataegus faxonii Sarg. листья (1), плоды (2); Crataegus rotundifolia Moench листья (3), плоды (4); Crataegus flabellata Kirchn. листья (5), плоды (6); Crataegus submollis Sarg. листья (7), плоды (8); плоды Crataegus сanadensis Sarg листья (9), плоды (10); листья Crataegus faxonii Sarg, а также листья (11) Crataegus faxonii Sarg. и (12) Crataegus сanadensis Sarg. после механической обработки. Впервые ряд экспериментальных методов исследования был опубликован в [12] и развит авторами в настоящей статье.
Определение содержания экстрактивных веществ в образцах (1–12) проводили по методике 2, описанной в ГФ РФ XV ОФС.1.5.3.0006. [7].
Количественное определение дубильных веществ в образцах (1–12) проводили по методикам, описанным в [7, 13].
Сырье сушили методом воздушно-теневой сушки в хорошо проветриваемых помещениях при температуре 25–27 ºС до остаточной влажности не более 12%, измельчали и просеивали через сито с отверстиями 2 мм. Определение влажности проводили термогравиметрическим экспресс-методом на приборе «Элвиз-2». Измельченные высушенные на воздухе листья и плоды изучаемых 5 видов боярышника экстрагировали при комнатной температуре гексаном (троекратное настаивание), высушивали на воздухе, экстрагировали 70%-ным этанолом и настаивали в течение суток. Соотношение исходное сырье: растворитель 1:10 по весу. Экстракцию проводили 5 раз. Экстракт фильтровали, после чего объединенные вытяжки концентрировали выпариванием растворителя на водяной бане в вакууме досуха. Получены густые экстракты образцов (1–12).
Предварительное изучение качественного состава полученных экстрактов проводили методом двумерной бумажной хроматографии (БХ) и хроматографии в тонком слое сорбента (ТСХ) на хроматографической бумаге – FN-11 (ГДР), пластинах Silufol UV-254 (Чехия), Sorbfil ПТСХ АФ–А-УФ. Двумерное хроматографирование осуществляли в системах растворителей: I – н-бутиловый спирт: кислота уксусная: вода (4:1:2) / 15%-ная кислота уксусная; для ТСХ использовали систему II – хлороформ: этанол (2:1). В качестве стандартных веществ брали спиртовые растворы кофейной и хлорогеновой кислот, кверцетина, рутина, апигенина, кемпферола, лютеолина. Детектирование зон адсорбции флавоноидов и фенолкарбоновых кислот проводили в видимом и УФ-свете до и после обработки парами аммиака, 2%-ным спиртовым раствором алюминия хлорида.
Количественное определение суммы флавоноидов в образцах (1–12) проводили на спектрофотометре «Uvicon» 943 с использованием метода, основанного на реакции комплексообразования с алюминия хлоридом в пересчете на кверцетин.
Содержание суммы флавоноидов в пересчете на кверцетин и абсолютно сухое сырье в процентах вычисляли по формуле:
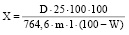 ,
,
где D – оптическая плотность исследуемого раствора; 764,6 – удельный показатель поглощения комплекса кверцетина с алюминия хлоридом при λmax 430 нм; m – масса сырья, г; W – потеря в массе при высушивании сырья, %.
Для определения количественного содержания кислоты аскорбиновой применен разностный метод, основанный на возможности устранения поглощения кислоты аскорбиновой путем ее окисления в присутствии меди сульфата [9]. Анализ проводили на спектрофотометре «Uvicon» 943 при температуре +20оС в кюветах толщиной 1 см на длине волны 220 нм относительно оптической плотности калибровочных образцов (0,001 до 0,01 г/л). Для анализа 0,1 г сухого экстракта растворяли в 25 мл 70%-ного этанола, одну из двух одинаковых порций раствора обрабатывали небольшим количеством натрия сульфата для стабилизации кислоты аскорбиновой. К другой порции добавляли меди сульфат (≈5 г на 1 л), который катализирует окисление кислоты аскорбиновой.
Механическую обработку порошка образцов (1) и (9) проводили в планетарно-центробежной мельнице АГО–2: ускорение – 60 g; объем барабана – 35 см2; загрузка шаров диаметром 5 мм – 75 г, загрузка обрабатываемого материала – 2,5 г.
Определение антиоксидантной активности образцов (1–12) проводили на приборе ТА–2 с трехэлектродной ячейкой (рабочий электрод – ртутно-пленочный, сравнения и вспомогательный – хлорсеребряные). В качестве фонового электролита использовали фосфатный буфер рН = 6,86 (10 мл).
Анализ флавоноидов проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на приборе «Agilent 1100 series LC/MSD». Детектирование осуществляли УФ-детектором при длинах волн: 255 нм, 370 нм и 440 нм. Идентификацию веществ проводили путем сравнения их времени удерживания с таковыми для индивидуальных веществ.
Результаты исследования и их обсуждение
Содержание экстрактивных веществ вычисляли в процентах (Х %) в пересчете на абсолютно сухое сырье, полученные результаты представлены в таблице 1.
Наибольший выход экстрактивных веществ в листьях наблюдали в образцах (1), (3), (9); в плодах – в образцах (4) и (10), но он ниже, чем в листьях, примерно в 1,7 раза. В образцах (11) и (12), полученных в результате механической обработки образцов (1) (листья боярышника Факсона), и (9) (листья боярышника канадского) выход экстрактивных веществ выше, чем в исходных образцах, примерно в 1,2 раза.
Методом БХ и специфическими реакциями в образцах (1–12) установлено наличие флавоноидов, фенолокислот, кумаринов, дубильных веществ. Результаты качественных реакций показали присутствие в листьях конденсированных дубильных веществ в образцах (7), (9), (12), в остальных образцах преобладают гидролизуемые дубильные вещества. В плодах обнаружены только гидролизуемые дубильные вещества. Количественное определение дубильных веществ в образцах (1–12) проводили двумя методами: перманганатометрии (в пересчете на танин) и перманганатометрии в сочетании с осаждением дубильных веществ желатином. За окончательный результат принимали среднее значение 5 последовательных определений, результаты представлены в таблицах 2 и 3.
Таблица 1
Содержание экстрактивных веществ в образцах (1–12)
|
1 |
3 |
5 |
7 |
9 |
11 |
12 |
|
41,35% |
35,87% |
30,47% |
33,36% |
35,96% |
47,07% |
38,72% |
|
2 |
4 |
6 |
8 |
10 |
||
|
19,00% |
21,00% |
19,51% |
19,92% |
20,80% |
– |
– |
Примечание: составлено авторами.
Таблица 2
Результаты определения содержания дубильных веществ в образцах (1–12), полученных методом перманганатометрии (в пересчете на танин)
|
1 |
3 |
5 |
7 |
9 |
11 |
12 |
|
34,41% |
24,76% |
16,23% |
24,64% |
28,86% |
41,64% |
36,71% |
|
2 |
4 |
6 |
8 |
10 |
||
|
10,50% |
16,21% |
11,81% |
13,73% |
15,91% |
– |
– |
Примечание: составлено авторами.
Таблица 3
Результаты определения содержания дубильных веществ в образцах (1–12), полученных методом перманганатометрии в сочетании с осаждением дубильных веществ желатином
|
1 |
3 |
5 |
7 |
9 |
11 |
12 |
|
2,01% |
1,73% |
1,21% |
1,40% |
1,91% |
3,30% |
3,00% |
|
2 |
4 |
6 |
8 |
10 |
||
|
0,91% |
0,82% |
1,01% |
0,78% |
0,99% |
– |
– |
Примечание: составлено авторами.
Таблица 4
Содержание флавоноидов в образцах (1–12)
|
1 |
3 |
5 |
7 |
9 |
11 |
12 |
|
2,41% |
1,90% |
1,11% |
0,96% |
1,35% |
12,27% |
7,15% |
|
2 |
4 |
6 |
8 |
10 |
||
|
0,51% |
0,22% |
0,33% |
0,25% |
0,40% |
– |
– |
Примечание: составлено авторами.
Как видно из таблиц 2 и 3, после механической обработки выход дубильных веществ повысился примерно в 1,5–1,6 раза.
В результате исследования 70%-ных этанольных экстрактов образцов (1–12) хроматографическими методами: БХ в системе I и ТСХ в системе II, ВЭЖХ (детектирование осуществляли УФ-детектором при длине волны 254 нм) – в сравнении с достоверными образцами и литературными данными во всех образцах идентифицированы: гиперозид, кверцетин, рутин, лютеолин, кемпферол, апигенин, хлорогеновая и кофейная кислоты.
Результаты количественного определение суммы флавоноидов в пересчете на кверцетин приведены в таблице 4.
За конечный результат принимали среднее значение трех определений.
Данные таблицы 4 показывают, что содержание флавоноидов в листьях значительно превышает их содержание в плодах. Механохимическая обработка позволила повысить выход флавоноидов примерно в 5 раз. Наибольшее содержание флавоноидов наблюдается в образцах под номерами (1), (3) и (5). При механохимической обработке листьев Crataegus faxonii Sarg и Crataegus сanadensis Sarg (образцы 11 и 12) выход экстрактивных флавоноидов многократно увеличивается.
По сравнению с фармакопейными видами боярышника, например боярышника кроваво-красного, содержание флавоноидов в листьях боярышника Факсона выше, у остальных видов содержание примерно одинаковое (на уровне 1,5–2%). В плодах фармакопейных видов содержание флавоноидов 0,1–0,3%, в изучаемых авторами видах их содержание чуть больше (около 0,4 %).
Определение аскорбиновой кислоты. Согласно литературным данным [14], в листьях и плодах боярышника содержится кислота аскорбиновая, которая является стимулятором иммунитета, сильным природным антиоксидантом. Поэтому представляло интерес изучить ее содержание в изучаемых видах боярышника.
Таблица 5
Содержание кислоты аскорбиновой в образцах (1–5)
|
№ образца |
1 |
2 |
3 |
4 |
5 |
|
Концентрация аскорбиновой кислоты, С, г/л |
0,0030 |
0,0028 |
0,0028 |
0,0029 |
0,0031 |
Примечание: составлено авторами.
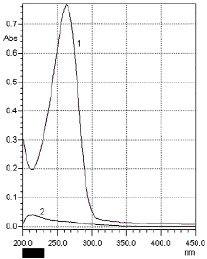
Спектр поглощения раствора аскорбиновой кислоты – 1, спектр раствора кислоты аскорбиновой с добавлением меди сульфата – 2 Источник: составлено авторами
На рисунке приведен спектр поглощения раствора кислоты аскорбиновой до и после обработки раствором меди сульфатом. Кривая 2 на рисунке показывает поглощение раствора после устранения аскорбиновой кислоты (в результате реакции с меди сульфатом).
Содержание кислоты аскорбиновой в плодах пяти изучаемых североамериканских видах боярышника представлено в таблице 5.
Определение антиоксидантной активности проводили методом вольтамперометрии [15]. Все образцы показали достаточно высокую антиоксидантную активность по отношению к процессу восстановления кислорода, наиболее активными оказались образцы (1), (7), (9). Эти данные четко коррелируют с содержанием веществ флавоноидной структуры. Образцы (11) и (12) – экстракты, полученные из листьев, подвергнутых механической активации, – показали очень хорошую антиоксидантную активность по сравнению с такими стандартными антиоксидантами, как кверцетин и кислота аскорбиновая. Определено, что экстракты плодов обладают большей антиоксидантной активностью по сравнению с экстрактами листьев, поскольку содержание кислоты аскорбиновой в них значительно выше.
Заключение. Проведено исследование химического состава листьев и плодов североамериканских видов боярышника: Crataegus faxonii Sarg.; Crataegus rotundifolia Moench; Crataegus flabellata Kirchn.; Crataegus submollis Sarg.; Crataegus сanadensis Sarg. культивируемых на территории Сибири. Получены 70%-ные этанольные экстракты методами БХ и ТСХ, специфическими реакциями установлено наличие флавоноидов, фенолокислот, кумаринов, дубильных веществ. Методом ВЭЖХ в сравнении с рабочими стандартными образцами идентифицированы: кофейная и хлорогеновая кислоты, кверцетин, рутин, апигенин, кемпферол, лютеолин. Определено содержание экстрактивных веществ в листьях (30,47–41,35%) и плодах (19,00–21,00%); фенольных соединений в листьях (16,23–34,41%), в плодах (10,50–16,21%) изучаемых объектов. Методом спектрофотомерии проведено количественное определение флавоноидов в пересчете на кверцетин и кислоту аскорбиновую, содержание флавоноидов в листьях (0,96–2,41%) выше, чем в плодах (0,22–0,51); содержание кислоты аскорбиновой определяли только в плодах (≈0,03%). Отмечено, что механическая обработка / измельчение сырья до дисперсного порошка позволяют увеличить выход экстрактивных веществ, фенольных соединений и флавоноидов. Проведено определение антиоксидантной активности 70%-ных этанольных экстрактов плодов изучаемых видов боярышника методом вольтамперометрии. Все экстракты показали антиоксидантную активность, близкую к стандартным антиоксидантам.

