Введение
IgMN – редкая клинико-морфологическая форма гломерулопатии, характеризующаяся отложением IgM в мезангии клубочков. Заболевание может встречаться как у детей, так и у взрослых, чаще проявляется идиопатическим нефротическим синдромом [1-3].
Впервые IgMN была описана в 1978 г. [4]. При морфологическом исследовании биоптатов характерны мезангиальная гиперклеточность и отложения IgM и C3 при иммунофлуоресцентном анализе (ИФА) [5]. Вопрос о самостоятельности этой нозологии остаётся дискуссионным: одни исследователи считают её промежуточной формой между болезнью минимальных изменений (БМИ) и фокально-сегментарным гломерулосклерозом (ФСГС), другие – отдельной формой гломерулонефрита [1; 6].
Частота IgMN, по данным разных центров, варьирует от 2 до 18,5% [1; 3]. В среднем IgMN диагностируют у 2% пациентов с хроническим гломерулонефритом, подтвержденным биопсией почки. Протекает с высокой клинической активностью, часто дебютирует нефротическим синдромом. Морфологически может представлять собой как мезангиопролиферативный гломерулонефрит, так и БМИ [7; 8].
Патогенез IgMN окончательно не ясен [4]. Предполагается участие иммунных комплексов и активация комплемента (C1q, C4, C3), а также нарушения в работе Т-лимфоцитов и клиренсе иммунных комплексов [3].
Клинические проявления варьируют от бессимптомной протеинурии до выраженного нефротического синдрома с анасаркой, гипоальбуминемией и гиперлипидемией [8; 9].
Возможны системные проявления, требующие дифференциальной диагностики с системными аутоиммунными заболеваниями, в первую очередь – системной красной волчанкой (СКВ), мембранозным нефритом, васкулитами АНЦА-ассоциированного спектра [10].
Основу терапии составляют нефропротективные меры, включающие ограничение соли и жидкости, приём диуретиков, ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина II (БРАII), которые способствуют снижению внутриклубочкового давления и уменьшению протеинурии [11; 12]. Глюкокортикостероиды (ГКС) являются препаратами первой линии, однако у взрослых пациентов нередко наблюдается стероидорезистентность [13; 14, с. 138]. При неэффективности монотерапии ГКС возможен переход к иммуносупрессивной терапии второго ряда – цитостатикам и ритуксимабу [15].
У 5–15% пациентов развивается терминальная стадия ХБП в течение 10–15 лет. Возможны рецидивы после трансплантации почки, тромбозы глубоких вен и тромбоэмболия легочной артерии (ТЭЛА) при тяжёлом нефротическом синдроме [5; 16].
С целью систематизации данных о данной патологии, разработки четких диагностических критериев и унификации подходов к лечению пациентов Национальная ассоциация нефрологов инициировала создание базы клинических случаев. Этот банк данных регулярно обновляется и пополняется новой информацией.
Цель исследования: анализ клинического случая IgMN для выявления ключевых диагностических и прогностических маркеров, роли биопсии в верификации диагноза и междисциплинарного подхода при тяжёлом течении заболевания.
Материал и методы исследования
Проведен ретроспективный анализ клинического случая пациентки, находившейся на лечении в нефрологическом отделении ГБУЗ РМ «МРЦКБ» (г. Саранск). Исследование включало детальное изучение анамнеза, динамики развития патологии, данных лабораторной диагностики (биохимический анализ крови, общий анализ мочи, иммунологические маркеры) и инструментальных методов (ультразвуковое исследование (УЗИ) почек, биопсия с иммуногистохимией), а также оценку эффективности применяемой терапии.
Результаты исследования и их обсуждение
Пациентка Н., 37 лет, поступила 06.08.2024 с жалобами на одышку при минимальной нагрузке, отёки нижних конечностей, повышение АД до 200/100 мм рт. ст., общую слабость. В анамнезе заболевания почек отрицает, патологий мочи ранее не было. С 01.07.2024 самостоятельно принимала нестероидные противовоспалительные препараты (НПВП) по поводу артралгий. С 16.07.2024 – прогрессирующее ухудшение состояния: нарастание отёков, одышки. Была госпитализирована в РКБ им. Каткова, где выявлены: протеинурия 7,28 г/сут., креатинин – 250 мкмоль/л, мочевина – 11,5 ммоль/л. После лечения (медицинские документы не были предоставлены) отмечена частичная положительная динамика.
30.07.2024 при консультации в ГБУЗ РМ «МРЦКБ» проведено дообследование: креатинин 148 мкмоль/л, мочевина 11,6 ммоль/л, гипоальбуминемия (альбумин 25 г/л), протеинурия 0,9 г/л, микрогематурия, анемия (Hb 103 г/л), СОЭ 20 мм/ч, гидроторакс по данным УЗИ плевры, гидроперикард по эхокардиоскопии (ЭХОКС).
В анамнезе жизни – без особенностей, в процессе опроса выявлено, что мать умерла от почечной патологии.
По результатам осмотра – состояние средней тяжести, пастозность лица и нижних конечностей, частота сердечных сокращений (ЧСС) – 78 уд./мин., артериальное давление (АД) – 170/100 мм рт. ст., частота дыхательных движений (ЧДД) – 17 в минуту, SpO₂ – 99%. Данные объективного осмотра органов дыхания, желудочно-кишечного тракта (ЖКТ), мочевыделительной и сердечно-сосудистой системы (ССС) – без выраженных отклонений. Диурез – около 1200 мл/сут.
Учитывая женский пол, возраст, нефротический синдром и положительный семейный анамнез, заподозрена СКВ. Проведено лабораторное обследование: положительные АНА и anti-dsDNA. С 06.08.2024 начата иммуносупрессивная терапия: пульс-терапия метилпреднизолоном 1000 мг/сут. (3 дня), затем переход на преднизолон 50 мг/сут. перорально.
Таблица 1
Показатели общего анализа мочи в динамике
|
06.08.2024 |
22.08.2024 |
03.09.2024 |
11.09.2024 |
23.09.2024 |
|
|
Цвет (желтый) |
Желтый |
Желтый |
Желтый |
Желтый |
Желтый |
|
Прозрачность (прозрачная) |
Слабо мутная |
Слабо мутная |
Мутная |
Мутная |
Мутная |
|
Удельный вес (1,010 – 1,020) |
1,009 |
1,010 |
1,014 |
Мало мочи |
Мало мочи |
|
Реакция (слабокислая) |
Кислая |
Кислая |
Кислая |
Кислая |
Кислая |
|
Белок (г/л) |
1,7 |
0,740 |
2,4 |
2,4 |
7,2 |
|
Лейкоциты (0-6 в п/зр) |
7-9 |
1-2 |
1-2 |
2-4 |
2-4 |
|
Эритроциты измененные (не обнаружено) |
45-55 |
10-14 |
В большом количестве |
47-55 |
В большом количестве |
|
Эритроциты неизмененные (0-2 в п/зр) |
2-4 |
9-10 |
4-6 |
||
|
Плоский эпителий (0-3 в п/зр) |
2-3 |
0-1 |
0-1 |
0-1 |
1-2 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Таблица 2
Показатели общего анализа крови в динамике
|
06.08.2024 |
13.08.2024 |
23.08.2024 |
02.09.2024 |
10.09.2024 |
23.09.2024 |
|
|
Гемоглобин (г/л) |
73 |
74 |
75 |
62 |
111 |
74 |
|
Эритроциты (х1012/л) |
2,60 |
2,58 |
2,53 |
1,99 |
3,58 |
2,37 |
|
Гематокрит (%) |
21,6 |
21,9 |
22,8 |
18,7 |
34,1 |
22,3 |
|
Тромбоциты (х109/л) |
60 по Фонио |
138 |
123 |
88 |
145 |
30 по Фонио |
|
Лейкоциты (х109/л) |
2,9 |
8,2 |
13,5 |
13,6 |
12,2 |
7,0 |
|
Лимфоциты (%) |
21 |
15 |
10 |
7 |
3 |
5 |
|
СОЭ (мм/ч) |
66 |
34 |
50 |
49 |
20 |
68 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
По данным динамического наблюдения за лабораторными показателями, в общем анализе мочи неуклонно продолжали нарастать протеинурия (7,2 г/л) и гематурия (табл. 1).
В общем анализе крови отмечалось снижение гемоглобина, тромбоцитов, эритроцитов и лимфоцитов, а также повышение СОЭ и снижение лейкоцитов, что свидетельствовало о сохраняющейся иммуновоспалительной активности на фоне терапии.
Кратковременное улучшение динамики после гемотрансфузии от 02.09.2024 сменилось повторным снижением показателей (табл. 2).
В биохимическом анализе крови отмечалось снижение общего белка и альбумина, рост креатинина и мочевины, указывающие на ухудшение почечной функции. После пульс-терапии метилпреднизолоном (06–08.08) к 13.08 наблюдалась временная положительная динамика, но затем показатели резко ухудшились. К 23.09.2024 диагностирована терминальная почечная недостаточность (табл. 3).
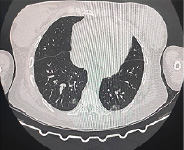
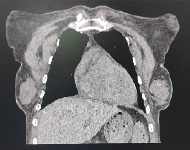
31.08.2024 у пациентки появились общая слабость, редкий кашель со слизистой мокротой, температура до 39,4°C утром. Проведены компьютерная томография органов грудной клетки (КТ ОГК) и ИФА мазка ротоглотки на антиген SARS-CoV-2. КТ ОГК выявила двустороннюю полисегментарную пневмонию (рис. 1А), гидроперикард, утолщение левого желудочка (рис. 1Б). ИФА на антиген SARS-CoV-2 – отрицательный. Полимеразная цепная реакция (ПЦР) от 02.09.2024 выявила COVID-19.
При отсутствии улучшения на фоне терапии ГКС, сохраняющейся анемии, ускорении скорости оседания эритроцитов (СОЭ) и нарушении функции почек (креатинин 177–173 мкмоль/л, скорость клубочковой фильтрации (СКФ) 31 мл/мин.) продолжен поиск основной болезни.
Таблица 3
Биохимические показатели крови в динамике
|
06.08.2024 |
13.08.2024 |
27.08.2024 |
02.09.2024 |
10.09.2024 |
23.09.2024 |
|
|
Общий белок (г/л) |
43,8 |
36,4 |
42,9 |
43,5 |
44,7 |
38 |
|
Мочевина (ммоль/л) |
11,6 |
20,7 |
22,4 |
21,8 |
38,8 |
38,4 |
|
Креатинин (мкмоль/л) |
215 |
177 |
222 |
264 |
189 |
438 |
|
Мочевая кислота (мкмоль/л) |
445,6 |
410,1 |
||||
|
Глюкоза (ммоль/л) |
4,72 |
4,51 |
4,79 |
|||
|
Холестерин (ммоль/л) |
5,56 |
|||||
|
Альбумин (г/л) |
19,2 |
17,0 |
21,1 |
24,2 |
||
|
СКФ (мл/мин.) |
24,6 |
31,0 |
23,7 |
19,2 |
28,7 |
10,4 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
(А) (Б)
Рис. 1. КТ ОГК, аксиальный срез (А), фронтальный срез (Б) Источник: составлено авторами по результатам данного исследования
(А) (Б)
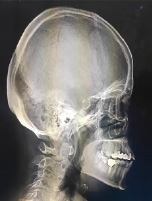
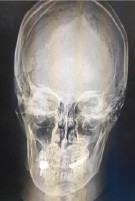
Рис. 2. Рентгенограмма черепа в боковой (А) и прямой (Б) проекциях Источник: составлено авторами по результатам данного исследования
Исключён антифосфолипидный синдром (отрицательные антитела к β2-гликопротеину, кардиолипину, фосфолипидам от 20.08.2024). Для исключения множественной миеломы 11.09.2024 исследована моча на белок Бенс-Джонса – положительно. Рентгенография черепа без костных деструкций, выявлено снижение пневматизации в левой верхнечелюстной пазухе с жидкостью (рис. 2). Стернальная пункция (12.09.2024) – нормальная клеточность, без гематологической патологии.
Для исключения системных васкулитов (гранулематоз Вегенера, синдром Чарджа – Стросса) исследованы антитела к миелопероксидазе (MPO) и протеиназе 3 (PR3) – отрицательные. КТ придаточных пазух носа подтвердила левосторонний гайморит.
Наличие выраженной протеинурии, гипопротеинемии и гиперхолестеринемии, соответствующих нефротическому синдрому, потребовало дифференциальной диагностики с амилоидозом. 18.09.2024 г. выполнена чрескожная пункционная нефробиопсия. По гистологии (23.09.2024) верифицирован фокальный пролиферативный и склерозирующий гломерулонефрит с преимущественным свечением IgM в мезангии.
Основное лечение – патогенетическая терапия: пульс-терапия метилпреднизолоном (1000 мг/сут. внутривенно капельно 06–08.08.2024), затем преднизолон перорально с дозой 50 мг/сут. Симптоматическая терапия включала диуретики (фуросемид), гастропротекторы (омепразол), аллопуринол, гипотензивные (лозартан, амлодипин), антикоагулянты (гепарин), трансфузионную поддержку.
20.09.2024 г. отмечено резкое ухудшение: интенсивная боль и распирание в верхней трети левого бедра, геморрагические высыпания, субфебрильная лихорадка (37,4 °C), выраженные отеки лица, конечностей и передней брюшной стенки, боли в нижнем животе. При осмотре – разлитая гиперемия кожи с везикулярными геморрагическими элементами, напоминающими рожистое воспаление, локальная гипертермия, генерализованные отеки (анасарка).
Цветовое дуплексное сканирование (ЦДС) вен нижних конечностей показало сохранённую проходимость глубоких и поверхностных вен, признаки выраженного лимфостаза левой голени и бедра.
На фоне нефротического синдрома развились выраженная гипергидратация с анасаркой, рожеподобные высыпания и перитонизм, соответствующие нефротическому кризу. Принято решение о сеансах интермиттирующего гемодиализа с ультрафильтрацией.
24.09.2024 г. при прогрессировании одышки и анасарки после ультрафильтрации пациентка переведена в отделение реанимации и интенсивной терапии (ОРИТ), где проводилась симптоматическая терапия, респираторная поддержка и коррекция жизненно важных функций.
Несмотря на лечение, состояние ухудшалось: усиливалась слабость, нарастала дыхательная недостаточность с эпизодами выраженной одышки, потребовавшая экстренной интубации трахеи. Через 5 часов после перевода в ОРИТ зафиксирована асистолия. Реанимационные мероприятия длились 30 минут без восстановления эффективной сердечной деятельности.
В 17:40 того же дня констатирована биологическая смерть пациентки Н.
При патологоанатомическом вскрытии выявлены бледные кожные покровы с рассеянной мелкопетехиальной геморрагической сыпью на туловище и конечностях, постинъекционные подкожные кровоизлияния на передней брюшной стенке, умеренные отеки лица, туловища и верхних конечностей. В полости перикарда – 150 мл прозрачной желтоватой жидкости. Паранефральная жировая клетчатка умеренно развита, однородная, светло-желтая. Почки пестро-желтые с сохранением коркового и мозгового вещества; корковое вещество 0,4–0,7 см, пирамиды ярко-красные, набухшие.
Гистологически: очаги геморрагического пропитывания в паранефральной жировой клетчатке; часть клубочков с неравномерным утолщением капиллярных петель, сращением и облитерацией просветов, отдельные склерозированы; в мочевых пространствах – гомогенные слабоэозинофильные массы; строма с очагами хронической мононуклеарной инфильтрации.
Патологоанатомическое исследование подтвердило клинический диагноз.
Основной: хронический гломерулонефрит, смешанная форма, тяжелое непрерывно рецидивирующее течение (морфологически – фокальный пролиферативный и склерозирующий гломерулонефрит с преимущественным свечением IgМ), обострение. Иммуносупрессивная терапия («пульс» – терапия метилпреднизолоном, прием ГКС). Пункционная чрескожная нефробиопсия от 18.09.2024 г. Сеансы изолированной ультрафильтрации.
Осложнение: нефротический синдром, персистирующее течение. Нефротический криз (перитонизм, рожеподобные высыпания) от 20.09.2024 г. Тромбоцитопения. Гиперурикемия. ХБП С5 А4 (СКФ – 10 мл/мин.).
Сопутствующий: госпитальная двусторонняя полисегментарная пневмония, нетяжелое течение, ст. разрешения. ДН 0. Гемотрансфузия от 02.09.2024 г., 24.09.2024 г. Новая коронавирусная инфекция, вирусидентифицированная (ПЦР+ от 02.09.2024 г., отр. от 17.09.2024 г.), нетяжелое течение. Одонтогенный хронический синусит.
Заключение
Данное наблюдение иллюстрирует сложности диагностики IgMN у молодой пациентки с нефротическим синдромом. Неспецифичная клиника, включая женский пол, молодой возраст и положительные АНА и анти-dsDNA, изначально предполагала системную красную волчанку. Однако отсутствие ответа на ГКС и результаты нефробиопсии – фокальный пролиферативный и склерозирующий гломерулонефрит с доминирующим отложением IgM – подтвердили диагноз IgMN.
IgMN требует исключения аутоиммунных заболеваний даже при наличии серологических маркеров. Биопсия почки – золотой стандарт, особенно при резистентности к терапии. Летальный исход подчеркивает высокий риск нефротического криза и необходимость новых методов лечения, таких как таргетная иммуносупрессия или ингибиторы комплемента, для улучшения прогноза.

