Введение
Пневмония занимает одно из лидирующих мест среди причин смерти больных различного профиля всех возрастных групп [1, 2]. Проведение инвазивной искусственной вентиляции легких (ИВЛ) увеличивает риск развития пневмонии в 6–21 раз [3, 4]. Пневмония, возникающая после 48 ч интубации трахеи, считается вентилятор-ассоциированной (ВАП) [5, 6]. Прогрессирующая ВАП проявляется острым респираторным дистресс-синдромом (ОРДС) и тяжелым сепсисом [7, 8]. Летальность больных с ВАП составляет от 10 до 65 %, причем сама пневмония является причиной летального исхода примерно у 30 % пациентов [7, 9]. По типу возбудителей преобладает нозокомиальная бактериальная ВАП [6, 10, 11]. Главный компонент ее лечения – антибактериальная терапия (АБТ) [12, 13]. Эффективность АБТ инфекций нижних дыхательных путей снижается при развитии неоднородности легочной ткани и сопутствующей ей неравномерности регионарных легочных функций: вентиляции и перфузии [14, 15]. Развитию неоднородности способствуют: 1) неподвижность больного; 2) инвазивная ИВЛ методом вдувания; 3) регионарная внутрилегочная гипоксия; 4) несоответствие антибактериального препарата (АБП) микробному спектру [16, 17]. Несоответствие АБП легочной флоре вызвано тем, что в условиях патологической неоднородности легких посев бронхоальвеолярной лаважной жидкости 1 сегмента не может отражать микробиологическую картину 18 остальных [14, 18].
К сожалению, научные публикации I–II уровней доказательности, освещающие данные вопросы патофизиологии ВАП, отсутствуют, а в руководствах, учебных пособиях и стандартах лечения пневмонии эти регионарные механизмы патогенеза, открытые в середине – начале второй половины XX в., не упоминаются [19, 20]. Несмотря на то, что длительная ИВЛ сейчас проводится технически более качественно, чем 30–50 лет назад, инфицирование дыхательных путей полирезистентной госпитальной микрофлорой, сроки ИВЛ, госпитализации и летальность у пациентов с ВАП остаются высокими [5, 21]. Это подталкивает ученых к уточнению патогенеза, к поиску новых методов повышения эффективности терапии и профилактики инфекций нижних дыхательных путей [22]. На современном этапе развития медицины учение о региональных функциях легких крайне удачно вписывается в патогенез ВАП, ОРДС, сепсиса и открывает пути оптимизации лечения длительно вентилируемых пациентов [20, 23].
Таким образом, для эффективной профилактики и лечения ВАП необходимо четко представлять и целенаправленно корректировать факторы ее патогенеза, которые вызывают и поддерживают патологическую неоднородность легких: 1) гравитационный фактор повреждения легких в результате неподвижности; 2) воздействие ИВЛ методом вдувания на легкие, центральную и регионарную гемодинамику [24]; 3) регионарную гипоксию на фоне нарушения внутрилегочных механизмов гипоксической вазоконстрикции [25]; 4) неравномерность распределения АБП и микрофлоры в легких [26].
Единственным действенным методом коррекции гравитационного фактора возникновения застойных вентро-дорзальных различий гидратированности легких является кинетическая терапия (КТ) – позиционирование вентилируемого больного для устранения вертикального градиента внутриорганного распределения жидкости, газа и для восстановления вентиляции и перфузии, а значит, диффузии и оксигенации [27–29]. Отрицательное гемодинамическое действие ИВЛ методом вдувания устраняется режимами ИВЛ с минимальным эффективным средним внутригрудным давлением (вспомогательная, высокочастотная, протективная, внутрилегочная перкуссионная ИВЛ) на фоне нормализации механики дыхания под действием КТ [25, 30]. Для устранения гипоксической легочной вазоконстрикции в плохо вентилируемых участках легких в процессе КТ обоснованно использовать инфузию вазодилататора нитроглицерина [20, 31]. Эффекты нитроглицерина на легочную перфузию могут быть усилены гипнотиком пропофолом [27]. Для поддержания оптимальной концентрации АБП в инфицированных участках легких целесообразно связать режим введения препарата с другими методами лечения, восстанавливающими регионарные функции легких, например с КТ [32]. Неравномерность распределения микрофлоры в легких стоит учитывать при выборе режима позиционирования больного в процессе КТ, при выявлении возбудителя ВАП и при назначении АБП [33].
С учетом вышесказанного был разработан способ профилактики и лечения ВАП, использующий патогенетически обоснованное сочетание КТ с инфузией вазоактивного, седативного и антибактериальных препаратов [32].
Цель исследования – повысить эффективность терапии и профилактики инфекций нижних дыхательных путей у вентилируемых пациентов за счет коррекции неоднородности легких путем патогенетически обоснованного включения в комплекс лечения и профилактики ВАП кинетической терапии в сочетании с введением вазоактивного, седативного и антибактериальных препаратов.
Материалы и методы исследования
Для оценки эффективности применения разработанного способа в комплексе профилактики и лечения ВАП в ходе пилотного проспективного исследования обследовано 12 впоследствии выживших пациентов отделения реанимации и интенсивной терапии (ОРИТ) многопрофильного стационара, которым проводилась инвазивная ИВЛ не менее 48 ч. Показанием для начала и пролонгации ИВЛ служила стойкая дыхательная недостаточность (ДН) после операции и/или в результате болезни (табл. 1).
Критерии включения в исследование: 1) ИВЛ, продолжающаяся 25–48 ч (вторые сутки); 2) необходимость продления ИВЛ еще минимум на 24 ч, прогнозируемая по тяжести состояния и/или по критерию отлучения от респиратора (индекс Тобина f/Vt более 105 при дыхании в режиме СРАР с PEEP 5 см вод. ст. и FiO2 0,3); 3) отсутствие противопоказаний для переворота на живот (шока, кровотечения, открытых послеоперационных ран, лапаростомы, необходимости проведения экстракорпоральной гемокоррекции или мембранной оксигенации); 4) отсутствие признаков пневмонии исходно до интубации трахеи.
Критерии исключения из исследования: 1) быстрая положительная динамика общего состояния, отлучение от ИВЛ и экстубация в первые 10 ч исследования; 2) явная отрицательная динамика общего состояния с возникновением противопоказаний для переворота на живот в результате прогрессирования полиорганной недостаточности, хирургического сепсиса, экстренного оперативного вмешательства.
Изначально в исследование были включены 17 пациентов, из которых 5 были исключены: 4 были экстубированы в первые 10 ч исследования; 1 на третьи сутки исследования нуждался в экстренной релапаротомии. В итоге предметом анализа стали результаты обследования 12 длительно (более двух суток) вентилируемых впоследствии выживших пациентов, у которых наблюдались постепенные положительная динамика общего состояния, купирование дыхательной недостаточности, восстановление спонтанного дыхания и перевод в профильное отделение из ОРИТ. Средняя длительность ИВЛ у них составила 7,2±6,13 суток (табл. 1).
До включения в исследование и разделения на группы позиционирование всех больных было однотипным общепринятым. Ежедневно в 08:00 оценивали критерии включения в исследование и при их соответствии распределяли пациента в одну из групп методом слепых конвертов, после чего начинали различное лечение: у 6 больных основной группы использовали способ профилактики и лечения ВАП, включающий повороты пациента на 90 и 180° 8 раз в сутки (сумма углов поворотов 1080°/сут, табл. 3), в том числе ежедневное 6-часовое пребывание в положении на животе с седацией пропофолом, вазодилатацией нитроглицерином и с введением АБП [32]; у 6 больных контрольной группы продолжали общепринятую схему позиционирования без прон-позиции, не связанную с седацией, вазодилатацией и введением АБП. Пациенты контрольной группы поворачивались на 90° по схеме: спина – бок – спина – другой бок и так далее 8 поворотов в сутки (сумма углов поворотов 720°/сут, табл. 3).
Способ профилактики и лечения ВАП в основной группе исполняли следующим образом. Интубированного вентилируемого пациента начиная с 08:00 первых суток исследования (вторых суток ИВЛ) ежедневно укладывали в позиции КТ: 3 часа на спине; 2 часа на боку; 2 часа на другом боку; 3 часа на спине; 6 часов на животе; 4 часа на спине; 2 часа на боку; 2 часа на другом боку (табл. 3). Для профилактики трофических осложнений, когда больной лежал на животе 6 часов или на спине 4 часа, через каждые 2 часа изменяли центр тяжести больного, подкладывая подушки или валики под грудь и таз с одного и другого бока поочередно. Повороты больных проводили после стабилизации гемодинамики. Прон-позицию, а затем пребывание в этом положении выполняли на фоне инфузии пропофола со скоростью 3–10 мг/кг/час. Микроструйное введение пропофола начинали за 20 мин до поворота на живот и заканчивали перед поворотом на спину. Через 5 мин после поворота больного на живот начинали инфузию нитроглицерина в дозе 0,5–1 мкг/кг/мин длительностью 5 ч. При любой кратности дозирования АБП в основной группе одно из введений выполняли через 10 мин после поворота больного на живот. При двукратном режиме дозирования второе введение АБП выполнялось после поворота на бок, при трехкратном – второе и третье введения АБП выполняли в положении на спине (табл. 3).
В контрольной группе седацию пропофолом и вазодилатацию нитроглицерином выполняли независимо от положения тела по клиническим показаниям. Антибиотики, дозируемые 1 раз в сутки, вводили в положении на спине; дозируемые 2 или 3 раза в сутки – на спине и на боку (табл. 3).
Выбор АБП в обеих группах проводился по одинаковой деэксалационной схеме [34].
Больные обеих групп получали респираторную, нутритивную, гемодинамическую поддержку по единым схемам.
Таблица 1
Характеристика пациентов
|
№ п/п |
Пол |
Возраст |
Описание патологии и лечебных мероприятий |
Группа |
Срок ИВЛ, сут |
|
1. |
Ж |
87 |
Язвенная болезнь желудка, осложненная перфорацией. Распространенный серозно-фибринозный перитонит. Ушивание перфоративной язвы желудка. ИБС. Пароксизмальная форма ФП. ГБ 3 ст., контролируемая АГ, риск 4, ХСН 1. Состояние после перелома правой бедренной кости |
О |
3 |
|
2. |
М |
64 |
Флегмона мошонки. Невправляемая пахово-мошоночная грыжа справа. ГБ 3, контролируемая АГ, риск 4. Резидуальные явления перенесенного ОНМК (2). ИБС стенокардия напряжения. Пароксизмальная форма ФП. ХСН 2А |
О |
3 |
|
3. |
Ж |
53 |
Острый тромбоз аорто-подвздошных сегментов с обеих сторон. Острая ишемия нижних конечностей. Хроническая ревматическая болезнь сердца, приобретенный порок митрального клапана (стеноз), персистирующая форма ФП, резидуальные явления ОНМК, ГБ 3, АГ 3, риск 4 |
О |
4 |
|
4. |
Ж |
62 |
Неспецифический язвенный колит, тяжелое течение. Токсическая дилатация поперечно-ободочной кишки, перфорация, распространенный гнойный перитонит. Обструктивная резекция поперечно-ободочной кишки |
О |
5 |
|
5. |
М |
47 |
Структурная лобная эпилепсия, дебют. Эпистатус |
О |
4 |
|
6. |
М |
70 |
ХОБЛ 3 смешанный вариант, крайне тяжелое обострение. Бронхиальная астма, не контролируемая, тяжелое течение. Эмфизема, пневмосклероз. ОДН. ГБ 3, риск 4. Пароксизмальная форма ФП. Постгипоксическая энцефалопатия. Трахеостомия |
О |
12 |
|
7. |
М |
51 |
Эпилепсия. Эпистатус. Постгипоксическая энцефалопатия. Трахеостомия |
К |
14 |
|
8. |
М |
86 |
ИБС. Постоянная форма ФП. Тромбоэмболия легочной артерии без острого легочного сердца. ГБ 3, АГ 3, риск 4 |
К |
6 |
|
9. |
Ж |
53 |
Злокачественное новообразование шейки матки с распадом. Пузырно-влагалищный свищ. Острый тромбоз артерий левой нижней конечности. Гнилостная флегмона левого бедра и забрюшинного пространства. Сепсис. Хроническая анемия средней степени. Кахексия |
К |
4 |
|
10. |
М |
59 |
ХОБЛ 3 смешанный вариант, тяжелое обострение. ОДН. Вторичный бронхоспастический синдром. Трахеостомия |
К |
23 |
|
11. |
М |
66 |
Межкишечный абсцесс. Спайки брюшной полости. Операция лапаротомия, резекция тонкой кишки с анастомозом «бок в бок». ГБ 3, риск 4. Ожирение 3 ст. |
К |
5 |
|
12. |
Ж |
77 |
Спонтанный разрыв образования левой почки. Забрюшинная гематома слева. Острая постгеморрагическая анемия. Ангиомиолипома правой почки. ГБ 3, АГ 3, риск 4. Резидуальные явления перенесенного ОНМК. ИБС. Стенокардия напряжения ФК 2. Двухсторонний гидроторакс. Хронический вирусный гепатит С минимальной степени активности |
К |
3 |
Примечание: М – мужской, Ж – женский, О – основная, К – контрольная, ИБС – ишемическая болезнь сердца, ФП – фибрилляция предсердий, ГБ – гипертоническая болезнь, АГ – артериальная гипертензия, ХСН – хроническая сердечная недостаточность, ОНМК – острое нарушение мозгового кровообращения, ХОБЛ – хроническая обструктивная болезнь легких, ОДН – острая дыхательная недостаточность
Таблица 2
Шкала клинической оценки легочной инфекции, Clinical Pulmonary Infection Score (CPIS)
|
Параметры |
Баллы по шкале CPIS |
||
|
0 |
1 |
2 |
|
|
Секрет ТБД |
Нет или почти нет |
Обильный |
Обильный, гнойный |
|
Рентген грудной клетки |
Без инфильтратов |
Диффузные инфильтраты |
Очаговые инфильтраты |
|
Температура тела |
36,0–38,4 °C |
38,5–38,9 °C |
< 36 °C или > 39 °C |
|
Число лейкоцитов в крови (103/мм3) |
4–11 |
< 4 или > 11 |
< 4 или > 11 + сегментоядерные ≥ 50 % |
|
PaO2/FiO2 мм рт. ст. или SpO2/FiO2 |
> 240 или ОРДС* |
– |
< 240 + нет ОРДС* |
|
Микробиология секрета ТБД |
Отрицательная** |
– |
Положительная |
Примечание. * – ОРДС диагностируется при PaO2/FiO2 < 200 и при наличии острых диффузных билатеральных легочных инфильтратов по рентгенограмме, которые нельзя было объяснить кардиогенной природой или перегрузкой жидкостью;
** < 104/мл КОЕ при микробиологическом исследовании бронхоальвеолярной лаважной жидкости;
ТБД – трахеобронхиальное дерево, ОРДС – острый респираторный дистресс-синдром
Таблица 3
Последовательность изменений положения тела больных и введения антибактериальных препаратов [32], динамика SpO2/FiO2 в исследуемых группах, M±m
|
Основная группа |
Время суток |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Момент введения антибиотика |
III |
I, II, III |
III |
II |
||||||||||||||||||||||
|
№ позиции |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
1 |
|||||||||||||||||
|
Позиция |
На спине |
На боку |
На другом боку |
На спине |
На животе |
На спине |
На боку |
На другом боку |
На спине |
|||||||||||||||||
|
SpO2/FiO2 |
323±11,2 |
318±8,5 |
329±7 |
342±7,3 |
370±8,7 |
384±10,4 |
380±7,6 |
385±8,2 |
391±9,4 |
|||||||||||||||||
|
Контрольная группа |
Момент введения антибиотика |
III |
II |
III |
I, II, III |
|||||||||||||||||||||
|
№ позиции |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
1 |
|||||||||||||||||
|
Позиция |
На спине |
На боку |
На спине |
На другом боку |
На спине |
На боку |
На спине |
На другом боку |
На спине |
|||||||||||||||||
|
SpO2/FiO2 |
328±9,2 |
320±8,4 |
330±8,6 |
325±7,7 |
334±9,1 |
329±7,4 |
333±8,9 |
335±9,3 |
343±11 |
|||||||||||||||||
Примечание. I – однократный режим введения АБП; II – двукратный режим введения АБП; III – трехкратный режим введения АБП;
АБП – антибактериальный препарат.
Для прогнозирования необходимости продолжения ИВЛ оценивали индекс Тобина f/Vt (ЧД/ДО в литрах) [5, 20]. Для стандартизации измерений его определяли при дыхании в режиме СРАР с РЕЕР 5 см вод. ст. с FiO2 0,3 без поддержки давлением или объемом. ИВЛ продолжалась, если f/Vt был более 105.
Для диагностики ВАП использовали шкалу клинической оценки легочной инфекции CPIS (табл. 2). Пневмония выставлялась при оценке 6 и более баллов [35].
В связи с малым числом обследованных пациентов статистическая обработка истинных величин (наличие/отсутствие ИВЛ, пневмонии, основной и сопутствующей патологии) была ограничена подсчетом абсолютных чисел и частоты встречаемости (n, %). Для статистической обработки суррогатных клинических исходов (SpO2/FiO2) использовали программу Microsoft Excel 2012: описание выполняли с помощью подсчета средних арифметических величин и стандартной ошибки среднего (M+m), для анализа различий между повторными наблюдениями применен t-критерий Стьюдента для парных выборок. Статистически значимыми считались различия при p < 0,05.
Результаты исследования и их обсуждение
В начале исследования возраст пациентов в группах был сопоставим: в основной 63,83±5,71, в контрольной 65,33±5,66 лет (p < 0,05). Имелись межгрупповые различия по полу: в основной группе было 2 мужчины и 4 женщины, а в контрольной – 4 мужчины и 2 женщины. Однако для начального сравнения методов коррекции неоднородности легких при ВАП половая принадлежность пациента не играла принципиальной роли, поскольку, как показали масштабные исследования, в течении ВАП существенных гендерных различий нет. К тому же свободный круглосуточный прием экстренных пациентов в ОРИТ не позволял соблюдать жесткую стандартизацию групп по основным характеристикам, что возможно при плановой работе. Эта особенность исследований в условиях экстренной помощи многократно отмечалась учеными медицины критических состояний [1, 6, 25].
По основной и сопутствующей патологии группы были сопоставимы. В обеих группах были пациенты со схожими основной (хирургический сепсис, тромбо-эмболическая патология, ХОБЛ с бронхоспастическим синдромом, эпилепсия с эпистатусом, постгипоксическая энцефалопатия) и сопутствующей патологиями (ИБС, ГБ, АГ, пароксизмальная форма ФП, резидуальные явления ОНМК). По 3 пациента из группы до поступления в ОРИТ были прооперированы (50 %), по 4 пациента имели коморбидную патологию (66,6 %).
Все пациенты имели стойкую ДН и снижение оксигенирующей функции легких (ОФЛ), определяемой по SpO2/FiO2 < 400, однако не имели исходной пневмонии по рентгенографии при поступлении в стационар и по шкале CPIS в начале исследования (критерий включения). Средние исходные величины SpO2/FiO2 в начале исследования существенно не различались между группами: 323±6,09 в основной и 328±7,17 в контрольной (p < 0,05, табл. 3, рис. 1). Снижение оксигенации, компенсированное ИВЛ, было вызвано регионарными изменениями легких (ателектазы, гиповентиляция, умеренная диффузная инфильтрация), которые выявлялись на рентгенографии, могли сочетаться с трахеобронхитом, но не отвечали критериям ВАП и ОРДС.
Началу исследования предшествовало позиционирование на спине и боках и ИВЛ в среднем 36±3,34 ч в основной и 39±2,8 ч в контрольной группах, что не имело достоверных различий (p < 0,05) и создавало одинаковые предпосылки для развития ВАП.
Таким образом, исходно группы не имели достоверных различий по ОФЛ, при этом пневмония по шкале CPIS не диагностировалась (критерий включения). По возрасту, тяжести состояния и патологии группы также были в целом сопоставимы (табл. 1).
Влияние комбинированной КТ (ККТ) на ОФЛ в первые сутки исследования отражено в табл. 3 и на рис. 1. Наибольший вклад в повышение сатурации вносила позиция «на животе» с инфузией пропофола и нитроглицерина – рост показателя в основной группе составлял в среднем 8,2 % от 342±7,3 на спине до 370±8,7 на животе (p < 0,05). При этом SpO2/FiO2 вырастало в среднем на 21 % за сутки от 323±11,2 до 391±9,4 (p < 0,05). Такие изменения повторялись ежедневно и способствовали скорейшей нормализации ОФЛ в основной группе по сравнению с контрольной (табл. 3, рис. 1).
В контрольной группе динамика SpO2/FiO2 была менее заметной: в течение первых суток в группе контроля не зафиксировано ни одного статистически значимого изменения показателя оксигенации, средний суточный рост SpO2/FiO2 от 328±9,2 до 343±11 составил 4,6 % против 21 % в основной группе (табл. 3, рис. 1). Следовательно ККТ улучшала оксигенацию крови в 4,5 раза быстрей, а значит эффективней, чем традиционное лечение.
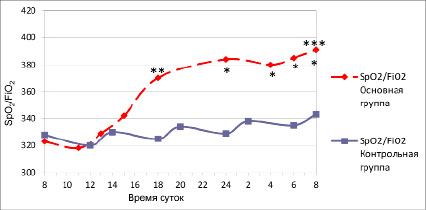
Рис. 1. Динамика SpO2/FiO2 в течение первых суток исследования в обеих группах (M±m) Примечание. * – межгрупповые различия достоверны, p < 0,05; ** – различия с предыдущей позицией в пределах группы достоверны, p < 0,05; *** – различия между начальной и конечной точками в течение суток в пределах группы достоверны, p < 0,05
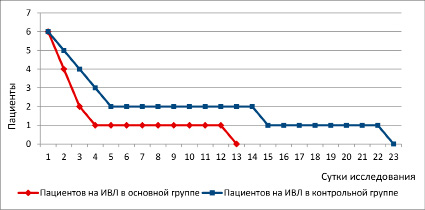
Рис. 2. Количество пациентов в исследуемых группах, находящихся на ИВЛ
Ускоренное восстановление ОФЛ закономерно отражалось на истинных клинических исходах: сроках ИВЛ, частоте и длительности пневмонии. Так, начиная со вторых суток исследования количество пациентов, отлученных от ИВЛ, преобладало в группе, где использовалась ККТ (табл. 4, рис. 2).
Динамика развития пневмонии в группах показала, что ВАП возникала в контрольной группе в 2 раза чаще: на 4-е сутки исследования у четырех пациентов диагностировалась пневмония по шкале CPIS. В основной группе пневмония диагностировалась только у двух пациентов (табл. 4, рис. 3). Последующий мониторинг ВАП показал, что к 5-м суткам исследования она была купирована у всех пациентов основной группы, в то время как в контрольной сохранялась в двух случаях. Суммарная длительность протекания ВАП, диагностированная по CPIS за 10 суток исследования, в основной группе была короче в 3,1 раза (9 против 28 суток в контрольной, табл. 4).
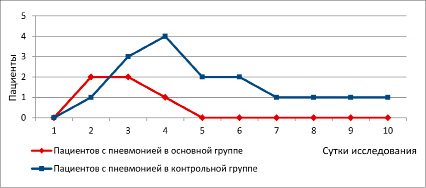
Рис. 3. Количество пациентов в исследуемых группах, у которых диагностирована ВАП
Таблица 4
Количество пациентов в исследуемых группах, находящихся на ИВЛ, и суток, проведенных на ИВЛ, количество пациентов с ВАП и суток, в течение которых диагностировалась ВАП
|
Сутки исследования |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10–22 |
Всего |
|
Сутки на ИВЛ с момента интубации |
2–3 |
3–4 |
4–5 |
5–6 |
6–7 |
7–8 |
8–9 |
9–10 |
10–11 |
11–24 |
|
|
Пациентов на ИВЛ, основная группа |
6 |
4 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
6 |
|
Пациентов на ИВЛ, контрольная группа |
6 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
2 |
2 |
6 |
|
Основная группа, суток на ИВЛ |
3+3 |
4+4 |
5 |
12 |
31 |
||||||
|
Контрольная группа, суток на ИВЛ |
3 |
4 |
5 |
6 |
14+23 |
55 |
|||||
|
Пациентов с пневмонией, основная группа |
0 |
2 |
2 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
Пациентов с пневмонией, контрольная группа |
0 |
1 |
3 |
4 |
2 |
2 |
1 |
1 |
1 |
1 |
4 |
|
Сроки ВАП, основная группа |
4 |
5 |
9 |
||||||||
|
Сроки ВАП, контрольная группа |
5+5 |
7 |
11 |
28 |
Более интенсивная положительная динамика как по срокам ИВЛ, так и по частоте развития пневмонии продолжалась в основной группе все последующие сутки до окончания исследования, что отражено в табл. 4. В итоге пациенты основной группы суммарно находились на ИВЛ 31 сутки, а пациенты контрольной – 55 суток (табл. 4, рис. 3). То есть под действием ККТ происходило снижение сроков ИВЛ в 1,8 раза – наиболее ценный истинный исход лечебного воздействия.
Таким образом, способ профилактики и лечения ВАП снижает частоту ее развития в 2 раза, длительность течения – в 3,1 раза, сроки проведения ИВЛ – в 1,8 раза.
Пилотное исследование посвящено оценке способа коррекции четырех факторов патогенеза ВАП в процессе лечения выживших пациентов: 1) гравитационного фактора повреждения легких в результате неподвижности; 2) воздействия ИВЛ методом вдувания; 3) регионарной гипоксии или гипероксии на фоне нарушения механизмов гипоксической вазоконстрикции; 4) неравномерность распределения АБП и микрофлоры в легких.
Чтобы устранить воздействие данных факторов, использовали ККТ – повороты пациента на 90 и 180° 8 раз в сутки (сумма углов поворотов 1080°/сут) с поочередным внутривенным введением в прон-позиции пропофола, нитроглицерина, АБП.
Применение способа профилактики и лечения ВАП (комбинированной КТ), направленного на устранение регионарной внутрилегочной неравномерности распределения вентиляции, перфузии, микрофлоры и антибактериальных препаратов, имело многоплановый эффект: 1) наблюдался быстрый рост ОФЛ во время и после переворота на живот и после суточного цикла кинетической терапии; 2) ускорялся процесс отлучения от респиратора; 3) профилактировалась либо разрешалась ВАП.
Быстрый значимый рост оксигенации после переворота на живот, а затем после возвращения из положения «на животе» в положение «на спине» ранее был многократно описан в публикациях, касающихся КТ и ее самого эффективного компонента – прон-позиции [36, 37]. В основе улучшения оксигенации в ходе КТ лежит нормализация исходно нарушенных вентиляционно-перфузионных отношений, а именно: снижение вено-артериального шунтирования и дыхательного мертвого пространства, увеличение жизненной емкости легких за счет устранения инфильтрации, дорзальных ателектазов и гиповентиляции [24, 38]. Восстановление вентиляции в отечных и ателектазированных участках легких в процессе КТ помимо увеличения оксигенации способствует подавлению анаэробных микроорганизмов в ранее невентилируемых альвеолах и бронхиолах [11, 22].
Инфузия пропофола до и во время переворота на живот за счет миорелаксирующего и сосудорасширяющего действий также способствовала росту оксигенации. Этот синергетический эффект КТ и пропофола ранее был описан при лечении ОРДС. Гипнотик имеет выгодные для ККТ ВАП свойства: 1) улучшает газообмен в легких за счет вазодилатации сосудов легких, расслабляющего действия на дыхательные скелетные мышцы и гладкую мускулатуру дыхательных путей, что выгодно для проведения ИВЛ и КТ; 2) нормализует гипердинамическую реакцию центральной гемодинамики за счет ваготонии и вазодилатации, центрального торможения симпато-адреналовой импульсации; 3) предполагается, что пропофол восстанавливает сосудистую реактивность, в том числе реактивность к гипоксемии – гипоксическую вазоконстрикцию; 4) облегчает процесс отлучения больного от аппарата ИВЛ за счет хорошей управляемости седацией, отсутствия вредных побочных влияний на психику и за счет положительного влияния на газообмен, является лучшим седативным средством отлучения больного от респиратора; 5) обладает антиоксидантными свойствами; 6) улучшает раннее энтеральное питание за счет противорвотного действия, ваготонии, симпато-адреналового торможения [5, 25].
Вторым инфузионным компонентом ККТ является нитроглицерин – венодилатирующее средство из группы нитратов [31]. Введение нитроглицерина, так же как и пропофола, сопровождается улучшением бронхиальной проходимости. Это связано с тем, что нитраты оказывают антиангинальное и спазмолитическое действие, расслабляют гладкую мускулатуру. При внутривенном введении нитроглицерин вызывает быстрое уменьшение преднагрузки на сердце за счет расширения периферических вен [12, 17]. При ИБС он способствует перераспределению коронарного кровотока в зоны ишемизированного миокарда. Уменьшая приток крови к правому предсердию, он способствует регрессу симптомов при отеке легких; снижает постнагрузку, потребность миокарда в кислороде (за счет снижения преднагрузки, постнагрузки и напряжения стенок желудочков в связи с уменьшением объема сердца). Вызывает расширение мозговых сосудов, чем объясняется головная боль при его применении [31]. Однако другой компонент способа профилактики и лечения ВАП, пропофол, нивелирует действие нитратов на мозг, так как уменьшает церебральный кровоток, внутричерепное давление, снижает церебральный метаболизм и устраняет головную боль.
Итак, пропофол и нитроглицерин, вводимые внутривенно, способствуют улучшению легочной перфузии и, следовательно, должны ускорять разрешение патологической легочной неоднородности и улучшать распределение АБП в тканях легких на фоне КТ. В прон-позиции улучшение легочной перфузии происходит в вентральных отделах, которые были плохо перфузируемыми на спине. Тут следует отметить, что вено-артериальный шунт может увеличиться, если легочная вазодилатация проводится без эффективного позиционирования больного.
Заключение
Включение в комплекс лечения длительно вентилируемых пациентов кинетической терапии, комбинированной с введением пропофола, нитроглицерина и антибактериальных препаратов, повышает эффективность терапии и профилактики ВАП за счет коррекции неоднородности легких. Данный способ профилактики и лечения ВАП снижает частоту ее развития в 2 раза, длительность течения – в 3,1 раза, сроки проведения ИВЛ – в 1,8 раза. В основе позитивного влияния комбинированной КТ на патогенез ВАП у выживших пациентов лежит устранение патологической неоднородности вентиляционно-перфузионных отношений в легких, что подтверждается ускорением восстановления показателя ОФЛ SpO2/FiO2 в 4,5 раза по сравнению с традиционным лечебным комплексом. Вторым возможным механизмом купирования пневмонии под действием ККТ может быть повышение эффективности АБТ за счет ускоренного внутрилегочного перераспределения АБП и микрофлоры. Проведенное пилотное исследование открывает перспективы для дальнейшего уточнения саногенетических механизмов, возникающих в процессе лечения ВАП, для поиска путей их стимуляции и поддержки.

