Введение
Гипотиреоз – заболевание эндокринной системы, которое развивается при недостаточной выработке щитовидной железой гормонов тироксина (Т4) и трийодтиронина (Т3) [1; 2]. Данные гормоны регулируют экспрессию генов, отвечающих за энергетический обмен, синтез белков, терморегуляцию и клеточную дифференцировку [3; 4]. Их недостаток приводит к снижению скорости метаболических процессов, что проявляется в виде системных нарушений [5–7] и объясняет слабость больных и непереносимость физической нагрузки. Кроме того, нарушается транскрипция генов, кодирующих транспортные белки (например, альбумин), что усиливает гипопротеинемию и отеки [8–10].
Для изучения структурно-функциональных изменений в различных органах и тканях в настоящее время исследователями широко применяются как хирургические, так и нехирургические методы моделирования экспериментальных патологических состояний.
Так, из уровня техники известен способ моделирования гипотиреоза [11], включающий применение тиамазола (мерказолила), который вводят однократно в желудок в виде водно-крахмальной суспензии в суточных дозах 5–50 мг/кг массы тела крысы в течение 21 дня. Способ позволяет получить модель гипотиреоза с возможностью спонтанного восстановления функции щитовидной железы и с сохранением нарушения функции на необходимое для развития терапевтического эффекта лекарственных средств коррекции время.
Однако способ имеет ряд существенных ограничений. Прежде всего, использование тиамазола (антитиреоидного препарата с известным механизмом действия) в виде водно-крахмальной суспензии при внутрижелудочном введении может быть недостаточно точным, поскольку биодоступность препарата может варьироваться в зависимости от индивидуальных особенностей животных, таких как моторика желудочно-кишечного тракта и кислотность содержимого, что снижает воспроизводимость модели. Кроме того, широкий диапазон дозировки (5–50 мг/кг) без четкого обоснования выбора конкретной дозы в тексте затрудняет стандартизацию метода и сравнение результатов между исследованиями. Также вызывает сомнение оценка спонтанного восстановления функции щитовидной железы: не указаны сроки, критерии и механизмы этого восстановления, а также отсутствуют данные о динамике уровней тиреоидных гормонов (Т3, Т4, ТТГ) на протяжении эксперимента, поэтому сложно объективно оценить степень выраженности и стабильность гипотиреоза. Еще одним недостатком является отсутствие контрольной группы, получавшей плацебо, что не позволяет исключить влияние стресса и других факторов, связанных с ежедневным внутрижелудочным введением, на общее состояние животных и метаболические показатели. В целом, хотя способ и позволяет добиться снижения функции щитовидной железы, его точность, воспроизводимость и клиническая релевантность требуют дополнительного обоснования и доработки.
Известен способ экспериментального моделирования гипотиреоза у лабораторных крыс [12], который включает содержание лабораторных крыс на рационе с низким содержанием йода по 20 г смеси в сутки индивидуально каждому животному в течение 30 дней, после чего осуществляют введение тиамазола в дозе 2,5 мг/100 г живой массы в течение 21 дня. Затем в восстановительный период животных также содержат на рационе с низким содержанием йода. Использование изобретения позволяет достичь гипофункции щитовидной железы, которая характеризуется снижением уровня тироксина и трийодтиронина в крови и повышением уровня тиреотропного гормона, а также сохранения данного состояния в восстановительный период после прекращения введения крысам тиреостатического средства.
Однако данный способ имеет ряд существенных недостатков. Во-первых, отсутствует информация о динамике гормональных показателей (Т3, Т4, ТТГ) на разных этапах эксперимента, что не позволяет точно оценить степень подавления функции щитовидной железы и эффективность модели. Во-вторых, применение низкойодного рациона в сочетании с мерказолилом может привести к слишком выраженному и не всегда физиологически обоснованному снижению тиреоидной активности, что делает модель менее релевантной для изучения клинических форм гипотиреоза у человека. В-третьих, использование дистиллированной воды для поения может повлиять на общее водно-электролитное состояние животных и, как следствие, исказить метаболические и гормональные параметры. Также не указаны сроки и критерии восстановления функции щитовидной железы, а отсутствие контрольной группы, не получавшей вмешательства, не позволяет исключить влияние стресса и изменений рациона на результаты исследования. Таким образом, хотя модель потенциально применима для оценки йодсодержащих препаратов, ее адекватность, точность и воспроизводимость требуют дополнительного обоснования и углубленного методологического анализа.
В связи с вышеизложенным нами предпринята попытка создания модели миниинвазивного хирургического гипотиреоза без удаления органа.
Цель исследования – экспериментально обосновать способ моделирования гипотиреоза у крыс.
Материалы и методы исследования
Для проведения эксперимента использовалось 15 взрослых крыс породы «Стандарт» массой 200–250 г. Все животные содержались в стандартных условиях вивария при температуре 22 °C, относительной влажности воздуха 55 % и 12-часовом световом цикле. Крысы получали стандартный рацион и воду ad libitum.
Гипотиреоз был индуцирован (смоделирован) путем прямого введения 0,9 % физиологического раствора хлорида натрия непосредственно в ткань щитовидной железы через малоинвазивный доступ путем пункции щитовидной железы иглой инсулинового шприца в теоретически рассчитанной и экспериментально подтвержденной дозе 2 мл.
Малоинвазивный доступ размером 1 см обеспечен вертикальным разрезом кожного покрова, подкожно-жировой клетчатки и мышечного слоя. После введения физиологического раствора непосредственно в ткань щитовидной железы вертикальный разрез ушивали послойно (мышечный слой, подкожно-жировая клетчатка, кожный покров) с последующим наложением асептической повязки на место оперативного вмешательства для создания асептических условий и предупреждения занесения инфекции.
Все оперативные вмешательства сопровождали с использованием золетил-ксилазинового наркоза по следующей схеме: золетил 0,3 мг в/м, ксиланит 0,8 мг в/м из расчета на 100 г массы тела животного продолжительностью от 30 мин до 1 ч, в зависимости от длительности оперативного малоинвазивного вмешательства. Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы лабораторного животного) и угнетению роговичного рефлекса. За период использования золетил-ксилазинового наркоза не было выявлено ни одного случая гибели крыс от остановки дыхания или нарушения сердечной деятельности, пробуждения во время операции зарегистрировано не было.
В течение 14 дней за крысами наблюдали. С целью выявления признаков гипотиреоза каждые три дня проводили взвешивание крыс для оценки динамики изменения массы тела и проводили тест «открытого поля» [13, с. 32]. Кроме того, на 1-й и 14-й дни эксперимента из хвостовой вены брали кровь для анализа уровня тироксина (T4), трийодтиронина (T3) и тиреотропного гормона (ТТГ). После окончания проведения эксперимента на 14-й день крысы были эвтаназированы, щитовидные железы извлечены и зафиксированы в 10 %-ном формалине для последующей гистологической обработки и микроскопического исследования.
Разрешение на проведение исследования дано локальным этическим комитетом (ЛЭК) ЧУОО ВО «Медицинский университет «Реавиз» (протокол ЛЭК номер 12 от 03.12.2024). Условия содержания в виварии лабораторных животных регламентированы РД-АПК 3.10.07.02-09 «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений», приказом Министерства здравоохранения Российской Федерации от 01.04.2016 г. № 199н «Об утверждении правил надлежащей лабораторной практики», ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными».
Результаты исследования и их обсуждение
У крыс, получавших физиологический раствор, наблюдалось значительное увеличение массы тела (на 50–80 г) по сравнению с началом эксперимента. К концу 14-го дня разница в массе тела между периодами была 260–330 г. В тесте «Открытое поле» крысы с гипотиреозом проявляли сниженную активность и слабую тревожность по сравнению с началом эксперимента. Концентрация T4 и T3 в крови крыс была значительно снижена, а уровень ТТГ, напротив, повышен, что обусловлено патофизиологическими механизмами, связанными с недостаточной функцией щитовидной железы и вторичным повышением стимуляции со стороны гипофиза с целью компенсации гормональной недостаточности [14, с. 7]. Эти изменения отражают типичную картину гипотиреоза, индуцированного экспериментально, и свидетельствуют о нарушении синтеза тиреоидных гормонов на периферическом уровне (табл. 2), по сравнению с началом эксперимента (табл. 1).
Таблица 1
Результаты анализа крови на гормоны щитовидной железы и тиреотропный гормон до начала эксперимента (на 1-й день проведения эксперимента)
|
№ крысы |
Т3 (нмоль/л) по результатам исследования на 1-й день проведения эксперимента (норма = 1,5) |
Т4 (нмоль/л) по результатам исследования на 1-й день проведения эксперимента (норма = 25,0±5,5) |
Тиреотропный гормон (мг на 1 мг) белка по результатам исследования на 1-й день проведения эксперимента (норма = 30,0±5,0) |
|
1 |
1,48 |
27,3 |
32,1 |
|
2 |
1,52 |
20,1 |
28,4 |
|
3 |
1,45 |
29,8 |
35,6 |
|
4 |
1,55 |
22,5 |
26,7 |
|
5 |
1,5 |
26,0 |
30,0 |
|
6 |
1,53 |
31,2 |
33,3 |
|
7 |
1,47 |
19,0 |
31,5 |
|
8 |
1,51 |
24,5 |
29,2 |
|
9 |
1,5 |
28,0 |
30,5 |
|
10 |
1,49 |
23,7 |
27,8 |
|
11 |
1,54 |
25,5 |
34,0 |
|
12 |
1,46 |
18,9 |
25,1 |
|
13 |
1,54 |
30,4 |
31,9 |
|
14 |
1,5 |
24,8 |
29,6 |
|
15 |
1,51 |
26,3 |
30,8 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Таблица 2
Результаты анализа крови на гормоны щитовидной железы и тиреотропный гормон после завершения эксперимента (на 14-й день проведения эксперимента)
|
№ крысы |
Т3 (нмоль/л) по результатам исследования на 14-й день эксперимента (норма = 1,5) |
Т4 (нмоль/л) по результатам исследования на 14-й день эксперимента (норма = 25,0±5,5) |
Тиреотропный гормон (мг на 1 мг) белка по результатам исследования на 14-й день эксперимента (норма = 30,0±5,0) |
|
1 |
0,6 |
10,2 |
58,0 |
|
2 |
0,5 |
8,5 |
62,3 |
|
3 |
0,4 |
12,0 |
65,7 |
|
4 |
0,7 |
6,8 |
55,1 |
|
5 |
0,57 |
5,8 |
65,7 |
|
6 |
0,44 |
6,2 |
51,9 |
|
7 |
0,67 |
10,0 |
55,0 |
|
8 |
0,5 |
5,45 |
68,8 |
|
9 |
0,76 |
3,51 |
70,1 |
|
10 |
0,8 |
5,1 |
57,5 |
|
11 |
0,76 |
4,99 |
58,8 |
|
12 |
0,6 |
6,7 |
59,0 |
|
13 |
0,6 |
13,2 |
61,2 |
|
14 |
0,51 |
8,0 |
66,7 |
|
15 |
0,4 |
12,0 |
58,7 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
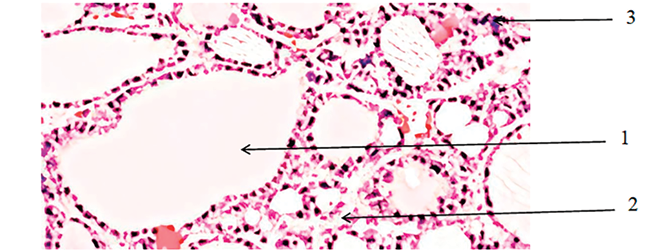
Морфология смоделированного гипотиреоза у крыс, окраска Г/Э, ув. Х 200: 1 – атрофия фолликулов, переполненных коллоидом с уплощением эпителия; 2 – разрастание соединительной ткани; 3 – лимфоцитарная инфильтрация Источник: фото микропрепарата получено авторами самостоятельно в ходе исследования
На гистологической картине отмечается атрофия фолликулов, переполненных коллоидом с уплощением эпителия. В строме наблюдается разрастание соединительной ткани с лимфоцитарной инфильтрацией (рисунок). Полученные результаты [15] подтверждают, что прямое введение физиологического раствора в щитовидную железу эффективно моделирует состояние гипотиреоза у крыс, вызывая характерные физиологические и морфологические изменения. Полученные данные могут быть полезны для дальнейшего изучения патогенеза гипотиреоза и разработки новых терапевтических стратегий.
Заключение
Таким образом, экспериментально подтверждено, что разработанный способ вызывает развитие гипотиреоза у крыс, что проявляется характерными физиологическими и морфологическими изменениями и может служить основой для дальнейших исследований в области эндокринологии и фармакологии. Полученные результаты подтверждают, что прямое введение 0,9 % физиологического раствора в щитовидную железу эффективно моделирует состояние гипотиреоза у крыс, вызывая характерные физиологические и морфологические изменения.

