Введение
Гипертиреоз – состояние, характеризующееся избыточной выработкой гормонов щитовидной железы (тироксина и трийодтиронина), что приводит к ускорению метаболизма и различным физиологическим изменениям в организме [1; 2]. Ткань щитовидной железы заполнена преимущественно сферическими тиреоидными фолликулами [3]. Каждый фолликул представляет собой слой кубовидных клеток (тиреоцитов), окружающих полость, заполненную коллоидом, главной составляющей которого является белок тиреоглобулин (ТГ) [4-6]. Клетки обращены внутрь полости апикальными поверхностями, на которых имеются микроворсинки, проникающие в коллоид. Между фолликулами располагаются кровеносные капилляры [7; 8].
Для изучения механизмов развития гипертиреоза и поиска эффективных методов лечения, несомненно, важно проводить эксперименты на лабораторных моделях.
Так, уже известен способ моделирования гипертиреоза [9], включающий пересечение диафрагмального нерва с последующей имплантацией его конца в ткань щитовидной железы. С целью введения животного в состояние тиреотоксического криза путем создания в организме избыточного количества гормонов щитовидной железы, через 2-3 мес. после имплантации нерва ткань щитовидной железы подвергают механическому разрушению.
Однако, несмотря на определённую эффективность данного способа, он имеет ряд существенных недостатков. Во-первых, использование местной анестезии с низкой концентрацией новокаина (0,025%) может быть недостаточным для полноценного обеспечения аналгезии в ходе сложного хирургического вмешательства, что повышает риск стресса и болевого шока у животных, а также может влиять на результаты эксперимента. Во-вторых, необходимость двукратного хирургического вмешательства увеличивает риск развития послеоперационных осложнений, таких как инфекция, воспаление или нарушение функции окружающих тканей, что может отрицательно сказаться на выживаемости подопытных особей и вносить дисбаланс в исследуемые параметры. В-третьих, механическое травмирование щитовидной железы зажимом Кохера может вызывать неспецифическое воспаление и фиброз, что затрудняет интерпретацию гормональных изменений и патоморфологических данных, поскольку эти изменения могут быть обусловлены не только гипертиреозом, но и посттравматической реакцией ткани. Кроме того, длительный период наблюдения (2-3 месяца) делает модель трудоёмкой и менее воспроизводимой в краткосрочных исследованиях. Наконец, использование собак вместо более распространённых лабораторных животных (например, крыс или мышей) ограничивает доступность модели и усложняет её стандартизацию.
Известен способ моделирования тиреотоксикоза и коллоидного зоба [10], согласно которому животному внутрижелудочно вводят тиреотом в еженедельно возрастающей дозе, начиная с 25 до 200 мкг/кг, в течение 6 недель с последующим определением функциональной активности щитовидной железы. Способ обеспечивает создание такой патологии щитовидной железы, которая позволяет получить в крови и периферических органах клиническую картину гиперфункции щитовидной железы, а в тиреоидной паренхиме создать патологию коллоидного зоба.
Несмотря на то, что способ моделирования тиреотоксикоза и коллоидного зоба позволяет достичь выраженной гиперфункции щитовидной железы и морфологических изменений в её ткани, он имеет ряд потенциальных недостатков. Во-первых, длительное внутрижелудочное введение тиреотома в возрастающих дозах (от 25 до 200 мкг/кг) в течение 6 недель является трудоёмким и требует строгого контроля за каждым этапом введения, что может снижать воспроизводимость модели в разных лабораториях. Во-вторых, индивидуальная вариабельность метаболизма препарата у животных может приводить к неоднородности модели – у некоторых особей может развиться недостаточно выраженный тиреотоксикоз или, напротив, чрезмерная стимуляция щитовидной железы, что затрудняет стандартизацию исследований. В-третьих, отсутствие хирургического контроля над состоянием щитовидной железы и уровнями гормонов в динамике введения препарата может ограничивать точность оценки развития патологии. Кроме того, сам механизм моделирования, основанный исключительно на фармакологическом воздействии, не воспроизводит возможных иммунных или нейрогуморальных компонентов, характерных для некоторых форм клинического гипертиреоза у человека, что снижает адекватность данной модели для изучения определённых патофизиологических аспектов заболевания.
Известен способ создания экспериментальной модели карциномы Льюиса в условиях гипертиреоза [11], согласно которому самкам и самцам мышей C57BL/6 в течение пяти дней вводят внутрибрюшинно лекарственное вещество лиотиронин в дозировке 20 мкг/100 г в 0,5 мл физиологического раствора с понедельника по пятницу 1 раз в день, затем подкожно перевивают карциному Льюиса в дозе 2 млн клеток в 0,5 мл физиологического раствора.
Преимущество способа заключается в возможности установить усиление злокачественного потенциала опухоли за счёт стимуляции её роста и снижения продолжительности жизни животных, изучать патогенез онкологического процесса в условиях коморбидной патологии, что особенно актуально для онкологической клиники, а также разрабатывать и тестировать адекватные терапевтические воздействия на опухоль, при этом предложенный метод является экономичным, воспроизводимым и доступным для использования в лабораторной практике.
Однако данный способ имеет ряд потенциальных ограничений. Во-первых, отсутствие детального описания метода индукции гипертиреоза у мышей снижает воспроизводимость эксперимента и затрудняет его сравнение с другими моделями. Во-вторых, не указаны конкретные параметры подтверждения гипертиреоза (например, уровни Т3, Т4, ТТГ), что сильно усложняет оценку степени выраженности эндокринного дисбаланса и его стабильности на протяжении всего исследования. В-третьих, использование карциномы Льюиса – агрессивной и быстро растущей опухоли – на фоне системного тиреотоксикоза может приводить к чрезмерной нагрузке на организм животных, что потенциально усиливает общее состояние истощения и сокращает срок наблюдения, ограничивая возможность изучать долгосрочные эффекты взаимодействия гипертиреоза и опухолевого роста. Кроме того, не рассмотрены возможные половые различия в ответе на комбинацию гипертиреоза и опухолевой патологии, несмотря на то что исследование проводилось на мышах обоего пола, что снижает информативную ценность модели в аспекте половых особенностей течения заболевания.
Цель исследования – экспериментально обосновать способ моделирования гипертиреоза у крыс.
Материалы и методы исследования
Для проведения эксперимента использовалось 15 взрослых крыс породы стандарт массой 200-250 г. Все животные содержались в стандартных условиях вивария при температуре 22 °C, относительной влажности воздуха 55% и 12-часовом световом цикле. Крысы получали стандартный рацион и воду ad libitum. Гипертиреоз был индуцирован (смоделирован) путем прямого введения суспензии левотироксина натрия (L-T4) [13, с. 201] в 0.9% растворе хлорида натрия в концентрации 0,94 мкг/мл непосредственно в ткань щитовидной железы через малоинвазивный доступ путем пункции щитовидной железы иглой инсулинового шприца в теоретически рассчитанной и экспериментально подтвержденной дозе 0,0125 мл/г.
Малоинвазивный доступ размером 1 см обеспечен вертикальным разрезом кожного покрова, подкожно-жировой клетчатки и мышечного слоя. После введения суспензии непосредственно в ткань щитовидной железы вертикальный разрез ушивали послойно (мышечный слой, подкожно-жировая клетчатка, кожный покров) с последующим наложением асептической повязки на место оперативного вмешательства для создания асептических условий и предупреждения занесения инфекции.
Все оперативные вмешательства сопровождали с использованием золетил-ксилазинового наркоза по следующей схеме: золетил 0,3 мг в/м, ксиланит 0,8 мг в/м из расчета на 100 г массы тела животного продолжительностью от 30 минут до 1 часа, в зависимости от длительности оперативного малоинвазивного вмешательства. Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы лабораторного животного) и угнетению роговичного рефлекса. За период использования золетил-ксилазинового наркоза не было выявлено ни одного случая гибели крыс от остановки дыхания или сердечной деятельности, а также пробуждения во время операции зарегистрировано не было.
В течение 14 дней за крысами наблюдали. С целью выявления признаков гипертиреоза каждые три дня проводили взвешивание крыс для оценки динамики изменения массы тела и проводили тест «открытого поля» [12, с. 32]. Кроме того, на 1-й и 14-й день эксперимента из хвостовой вены брали кровь для анализа уровня тироксина (T4), трийодтиронина (T3) и тиреотропного гормона (ТТГ). После окончания проведения эксперимента на 14-й день крысы были эвтаназированы, щитовидные железы извлечены и зафиксированы в 10%-ном формалине для последующей гистологической обработки и микроскопического исследования.
Разрешение на проведение исследования отражено локальным этическим комитетом (ЛЭК) ЧУОО ВО «Медицинский университет «Реавиз» (протокол ЛЭК номер 12 от 03.12.2024). Условия содержания в виварии лабораторных животных регламентированы РД-АПК 3.10.07.02-09 «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений», Приказом Министерства здравоохранения Российской Федерации от 01.04.2016 г. № 199н «Об утверждении правил надлежащей лабораторной практики», ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными.
Результаты исследования и их обсуждение
У крыс, получавших суспензию, наблюдалось значительное снижение массы тела (на 70 г) по сравнению с началом эксперимента. К концу 14-го дня разница в массе тела между периодами достигла максимума (120-180 г). В тесте «открытого поля» крысы с гипертиреозом проявляли повышенную активность и повышенную тревожность по сравнению с началом эксперимента. Концентрация T4 и T3 в крови крыс была значительно выше, а ТТГ понижен вследствие патофизиологических механизмов, связанных с подавлением секреции тропных гормонов из-за повышенной концентрации Т3 и Т4, что обусловлено ускоренными биохимическими процессами [14, с. 7] (табл. 2) по сравнению с началом проведения эксперимента (табл. 1), что подтверждает успешность индукции гипертиреоза.
Гистологический анализ, представленный на рисунке, показал пролиферативные изменения фолликулярного эпителия щитовидной железы с инвагинацией и уменьшением содержания коллоида, увеличением числа кровеносных сосудов и минимальной лимфоцитарной инфильтрацией в строму, что характерно для функциональной гиперплазии щитовидной железы.
Полученные результаты [15] свидетельствуют о том, что прямое введение суспензии в щитовидную железу успешно моделирует состояние гипертиреоза у крыс, вызывая характерные физиологические и морфологические изменения. Полученные данные могут быть использованы для дальнейшего изучения патогенеза гипертиреоза и разработки новых терапевтических подходов.
Таблица 1
Результаты анализа крови на гормоны щитовидной железы и тиреотропного гормона до начала эксперимента (на 1-й день проведения эксперимента)
|
№ крысы |
Т3 (нмоль/л) по результатам исследования на 1-й день эксперимента (норма = 1,5±0,05) |
Т4 (нмоль/л) по результатам исследования на 1-й день эксперимента (норма = 25,0±5,5) |
Тиреотропный гормон, мг на 1 мг белка по результатам исследования на 1-й день эксперимента (норма = 30,0±5,0) |
|
1 |
1,48 |
27,3 |
32,1 |
|
2 |
1,52 |
20,1 |
28,4 |
|
3 |
1,45 |
29,8 |
35,6 |
|
4 |
1,55 |
22,5 |
26,7 |
|
5 |
1,5 |
26,0 |
30,0 |
|
6 |
1,53 |
31,2 |
33,3 |
|
7 |
1,47 |
19,0 |
31,5 |
|
8 |
1,51 |
24,5 |
29,2 |
|
9 |
1,5 |
28,0 |
30,5 |
|
10 |
1,49 |
23,7 |
27,8 |
|
11 |
1,54 |
25,5 |
34,0 |
|
12 |
1,46 |
18,9 |
25,1 |
|
13 |
1,54 |
30,4 |
31,9 |
|
14 |
1,5 |
24,8 |
29,6 |
|
15 |
1,51 |
26,3 |
30,8 |
Примечание: составлено авторами на основе полученных данных в ходе исследования.
Таблица 2
Результаты анализа крови на гормоны щитовидной железы и тиреотропного гормона после завершения эксперимента (на 14-й день проведения эксперимента)
|
№ крысы |
Т3 (нмоль/л) по результатам исследования на 14-й день эксперимента (норма = 1,5) |
Т4 (нмоль/л) по результатам исследования на 14-й день эксперимента (норма = 25,0±5,5) |
Тиреотропный гормон (мг на 1 мг) белка по результатам исследования на 14-й день эксперимента (норма = 30,0±5,0) |
|
1 |
2,8 |
52,0 |
12,5 |
|
2 |
3,1 |
60,2 |
9,7 |
|
3 |
2,6 |
45,0 |
14,0 |
|
4 |
3,3 |
65,6 |
8,1 |
|
5 |
4,96 |
50,0 |
14,4 |
|
6 |
3,0 |
58,3 |
16,6 |
|
7 |
2,95 |
47,5 |
15,0 |
|
8 |
3,2 |
62,1 |
12,9 |
|
9 |
3,26 |
43,0 |
14,7 |
|
10 |
3,33 |
68,0 |
12,8 |
|
11 |
4,8 |
50,0 |
14,2 |
|
12 |
2,7 |
51,0 |
11,0 |
|
13 |
3,2 |
49,9 |
9,8 |
|
14 |
2,7 |
63,5 |
15,4 |
|
15 |
3,3 |
47,2 |
20,0 |
Примечание: составлено авторами на основе полученных данных в ходе исследования.
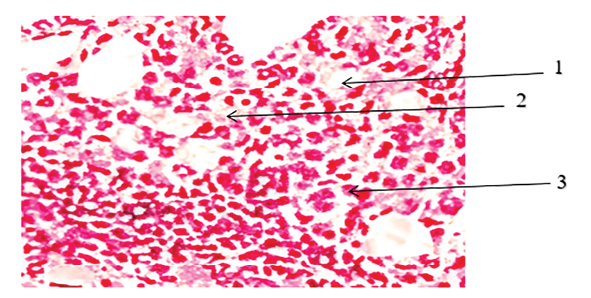
Морфология смоделированного гипертиреоза у крыс: 1 – пролиферативные изменения фолликулярного эпителия щитовидной железы с инвагинацией и уменьшением содержания коллоида; 2 – увеличение количества кровеносных сосудов; 3 – небольшое количество лимфоцитов. Окраска Г/Э, ув. х 200 Источник: фото микропрепарата получено авторами самостоятельно в ходе исследования
Заключение
Таким образом, экспериментально подтверждено, что разработанный способ вызывает развитие гипертиреоза у крыс, что проявляется характерными физиологическими и морфологическими изменениями и может служить основой для дальнейших исследований в области эндокринологии и фармакологии.

