Введение
Использование магнитных полей (МП) в лечебных целях представляется перспективным направлением. Однако с точки зрения гигиенического нормирования не все МП безопасны для организма [1]. В литературе неоднократно отмечено повреждающее действие магнитных полей высокой напряженности на различные органы и ткани. Поэтому наибольшую ценность для применения во врачебной практике имеют МП с низкой индукцией.
Согласно ранее опубликованным данным [2] для предупреждения деградации костного матрикса и потери костной массы найден оптимальный режим применения ПМП с индукцией 9мТл, используя ежедневные краткосрочные сеансы воздействия.
Учитывая тот факт, что реакция организма на МП реализуется с участием систем, обеспечивающих адаптацию [3], и затрагивает функции сердечно-сосудистой системы [4], представляет интерес исследовать влияние выработанного нами ранее [2] режима воздействия ПМП на функциональное состояние систем эндокринной регуляции и сердечной мышцы, как в условиях тепловой нагрузки, так и изолированно.
Материалы и методы
Исследования были проведены на 32 белых беспородных крысах-самцах массой 120-180 г. Все экспериментальные процедуры проводились согласно международным правилам по содержанию и работе с лабораторными животными [5].
Животные были разделены на четыре группы, сформированные методом парных аналогов. Животные первой группы подвергались изолированному действию термического фактора. Крысы помещались в камеру с температурой воздуха 700С ежедневно в течение 7 суток на 10 минут, как описано ранее [11]. Вторая группа животных ежедневно на протяжении 7 суток подвергалась изолированному действию ПМП с индукцией 9 мТл в течение 8 минут. Воздействие ПМП на животных производили на оригинальной установке УМ-7. Градиент индукции по продольной оси соленоида составляет 0,02±0,005 мТл/см. Одновременно в соленоид помещали 6-8 крыс. На крыс третьей экспериментальной группы воздействовали термический и магнитный фактор. Период между воздействиями факторов был равен 30 минутам. Интактные животные четвертой группы служили контролем.
Крыс выводили из эксперимента путем декапитации. На анализ отбирали левый надпочечник, плазму, сыворотку крови и сердце. Органы взвешивали. Массу надпочечников и сердца выражали в процентах от массы животного. Содержание 11-оксикортикостероидов (11-ОКС) в левом надпочечнике, сердце и плазме крови определяли по методу [6]. Концентрацию тестостерона, тироксина и трийодтирони-на в сыворотке определяли методом им-муноферментного анализа с использованием наборов фирмы Adaltis. Содержание гликогена в сердце определяли антороно-вым методом [7]. Уровень малонового диальдегида (МДА) в сердце определяли по реакции с 2-тиобарбитуровой кислотой [8]. Результаты биохимических анализов пересчитывали на массу органа.
Для проверки однородности дисперсий в группах применяли критерии Ливена. Результаты исследований представляли в виде среднего плюс/минус стандартная ошибка среднего. Различие средних значений в группах сравнивали с помощью стандартного t-критерия Стьюдента с учетом поправки Бонферрони [9].
Результаты
Действие термического фактора активировало функцию коры надпочечников, что выражалось в изменении массы желез и содержания 11-оксикортикостероидов в них и плазме крови крыс (табл.1).
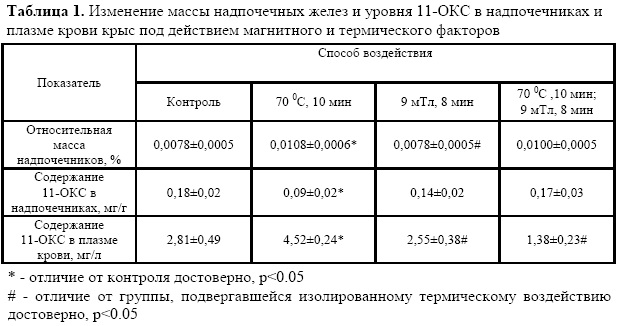
Как видно из результатов, представленных в таблице 1, под действием термического фактора увеличивалась масса надпочечников крыс, содержание 11-ОКС в плазме. Уровень глюкокортикоидов в надпочечниках снижался.
Ежедневные сеансы магнитного воздействия через 30 минут после действия термического фактора предупреждали реакцию на температурное воздействие со стороны гипоталамо-гипофизарно-адреналовой системы. Показатели, по которым оценивали функциональную активность надпочечников, не отличались от контроля.
Вместе с тем, изолированное действие магнитного поля, также не оказывало существенного влияния на функциональную активность надпочечников, судя по анализируемым показателям.
Функциональная активность щитовидной железы крыс, оцениваемая по уровню тироксина и трийодтиронина в сыворотке крови, не изменялась под действием повышенной температуры и магнитного поля (табл.2).
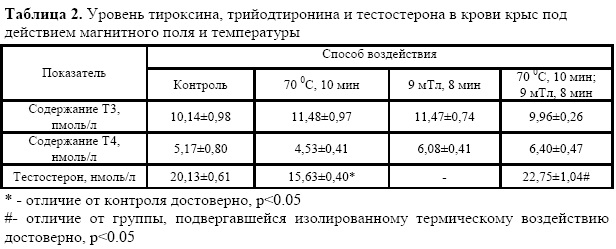
При изолированном воздействии температурного фактора на организм животных активность эндокринной функции семенников снижалась, что проявлялось в уменьшении содержания тестостерона в плазме крови животных данной опытной группы относительно контроля. В тоже время, как видно из данных (табл.2), экспозиция крыс в ПМП полностью восстанавливала уровень содержания тестостерона в крови животных.
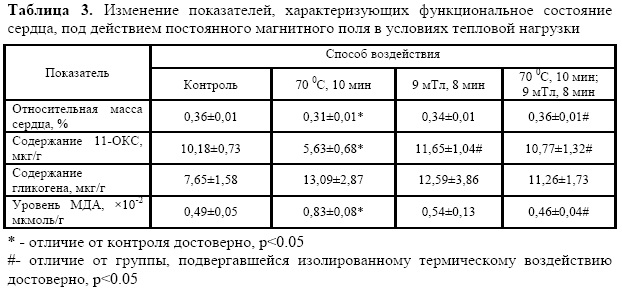
Относительная масса сердца животных, подвергавшихся действию повышенной температуры среды, была ниже контрольных значений (табл.3), что свидетельствует о неблагоприятном действии фактора на орган [11].
Действие ПМП каждый раз после термического воздействие возвращало значение данного показателя к норме. При этом изолированное действие магнитного поля на животных не приводило к изменению относительной массы их сердца.
Изолированное действие повышенной температуры повышало интенсивность перекисного окисления липидов сердца, что выражалось в увеличении содержания малонового диальдегида.
Действие магнитного поля через 30 минут после воздействия термического фактора полностью предотвращало повышение активности перекисного окисления липидов, индуцируемого повышенной температурой среды, и возвращало содержание малонового диальдегида в сердце к норме.
Ни изолированное, ни сочетанное действие термического и магнитного факторов не изменяло концентрации гликогена в сердце животных.
Обсуждение
Увеличение уровня 11-ОКС в плазме крови и снижение их содержания относительно физиологической нормы в надпочечниках свидетельствует о развитии неспецифической реакции со стороны гипо-таламо-гипофизарно-надпочечниковой системы крыс на действие термического фактора. Увеличение функциональной активности коры надпочечников животных при выбранном нами способе термического воздействия обнаруживается уже на третьи сутки действия фактора и носит фазный характер, с максимумами активности на пятые и седьмые сутки эксперимента [11]. Повышение содержания уровня глюкокортикоидов в крови приводит различным изменениям в организме на системном уровне [12], одним из которых является снижение эндокринной функции семенников, наблюдавшееся в эксперименте по снижению уровня тестостерона в плазме крови крыс.
Увеличение уровня глюкокортикоидов в крови крыс под действием термического фактора оказывало неблагоприятный эффект на функциональное состояние сердца животных, связанный с липо-тропным действием глюкокортикоидов. Как известно эти гормоны участвуют в реализации липидной триады, т.е. усиливают действие липаз, фосфолипаз, интенсивность перекисного окисления липидов и детергентное действие жирных кислот [13, 14]. По мнению авторов ряда работ, активация липидной триады способствует повреждению органа по свободноради-кальному механизму, снижению его массы и приводит к развитию патологий сердечно-сосудистой системы [15, 16]. При этом на протяжении семи суток температурного воздействия в органе происходят сложные биохимические процессы, определяющие нарастающее повреждение сердца [17].
Действие термического фактора не оказывало влияния на функциональную активность щитовидной железы, оцениваемую по содержанию тироксина и трий-одтиронина в крови животных. Можно предположить, что наблюдаемый эффект термического фактора на сердце обусловлен активацией гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) и снижением уровня тестостерона в крови. Изменение массы этого органа у самцов крыс при активации ГГНС в условиях ги-погонадизма показано [18].
Ежесуточное восьмиминутное воздействие ПМП с индукцией 9 мТл предотвращало активацию гипоталамо-гипофи-зарно-надпочечниковой системы под действием термического фактора и возвращало уровень тестостерона в крови в пределы физиологической нормы, а также предотвращало патогенное действие термического фактора на сердце. Изолированное действие ПМП не изменяло анализируемые показатели, что позволяет рассматривать его в качестве безопасного фактора, который может быть применен в медицинской практике. Заключение
Таким образом, семисуточное воздействие термического фактора активировало ГГНС, подавляло секрецию тестостерона семенниками и не сказывалось на функции щитовидной железы крыс. Действие повышенной температуры приводило к снижению массы сердца и повышению активности перекисного окисления липидов в нем. Эффекты термического воздействия не обнаруживались, если на крыс воздействовало ПМП 8 мТл через 30 минут после термического фактора. Изолированное действие ПМП в течение 8 минут не вызвало изменений исследуемых показателей.
СПИСОК ЛИТЕРАТУРЫ:
1. Григорьев Ю.Г. Космическая радиобиология. - М.: Энергоатомиздат, 1982. - 176 с.
2. Подковкин В.Г., Иванов Д.Г., Иванов Г. А. // Успехи современного естествознания, № 7, 2008. С. 13.
3. Подковкин В.Г., Слободянюк И.Л., Углова М.В. Влияние электромагнитных полей окружающей среды на системы го-меостаза Самара: Издательство «Самарский университет», 2000. - 108 с.
4. Бухарин Е.А., Богданов А.А., Бондарь И.И. // Материалы XXII итоговой научной конференции профессорско-преподавательского состава военно-медицинского факультета при Куйбышевском медицинском институте. Куйбышев, 1989. С .211.
5. Guide for the саге and use of laboratory animals National Academy Press Washington, D.C. 1996. 128p.
6. Подковкин В.Г. Микромодификация метода определения 11-оксикор-тикостероидов. Деп. в ВИНИТИ 4.7.1988 №5348-В 88
7. Практикум по биохимии / Под ред. Северина С.Е., Соловьевой Г.А. М.: Изд-во МГУ, 1989. - 509 с.
8. Современные методы в биохимии / под ред. В.Н. Ореховича. М.: Медицина, 1977. - 392с.
9. Гланц С. Медико-биологическая статистика. М.: Практика, 1998. - 459с.
10. Экологическая физиология животных. Часть II. Физиологические системы в процессе адаптации и факторы среды обитания / Под. ред. Слоним А. Д. и др. Л.: Наука, 1981. - 582с.
11. Подковкин В. Г., Иванов Д.Г. // Вестник Самарского государственного университета. 2006. №9. С.237.
12. Егорова, Л. И. Лечение глюкокор-тикоидами и АКТГ. М.: Медицина, 1965. - 306с.
13. Елисеев, В.В., Сапронов Н.С. Аденозин и функции миокарда. СПб: Изд-во «Лань», 2000. - 160с.
14. Меерсон Ф.З. Патогенез и предупреждение стрессорных и ишемических повреждений сердца. М.: Медицина,1984. - 270с.
15. Капелько В. И. // Русский медицинский журнал. Т. 11. №21. 2003. С. 15.
16. Шанин Ю.Н., Шанин В.Ю., Зиновьев Е. В. Антиоксидантная терапия в клинической практике. СПб: ЭЛЬБИ-СПб, 2003. - 128с.
17. Подковкин В. Г., Иванов Д.Г. // Вестник Самарского государственного университета. 2007. №8. С.198.
18. Кузьмина В. Е. // Вестник Самарского государственного университета. 2007. №8. С.129.

