Исследована антиоксидантная активность капотена(1-[(2S)]-3-меркапто-2-метил-пропионил]-L-пролина) в сравнении со стандартными антиоксидантами дибунолом (ионолом) и a-токоферолом в безводных инициированных и водно-липидных катализируемых субстратах. Установлена высокая антиоксидантная активность капотена в водно-эмульсионной среде. Показано участие капотена в процессе разрушения гидропероксидов молекулярным путем.
В настоящее время развитие гипертонической и ишемической болезней связывают с изменением интенсивности свободно-радикального окисления липидов биомембран [1, 2, 3]. Поэтому, при сердечно-сосудистой патологии применяют антиоксидантотерапию. В связи с этим, актуальной является проблема предварительного тестирования антиоксидантных свойств гипотензивных препаратов.
Целью работы являлось тестирование антиоксидантной активности капотенапри различных способах инициирования в безводных и водно-эмульсионных средах в сравнении с реперными антиоксидантами дибунолом и a-токоферолом.
Экспериментальная часть
Антиоксидантную активность (АОА) изучали манометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении метиллинолеата (МЛ) в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) при концентрации 1∙10−3 М, с добавками растворов хлорида меди (II) в количестве 2∙10−3 М при t = (60 ± 0,2) °С. Соотношение воды и эфира составляло 3:1, а общий объем пробы 4 мл [4, 5]. Кинетику поглощения кислорода в безводной среде изучали в среде инертного растворителя хлорбензола, процесс инициировали за счет термического разложения азо-бис-изо-бутиронитрила (АИБН) в концентрации 6∙10–3 М. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции, начальные и максимальные скорости окисления. Графическим методом определяли величину периода индукции (ti), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяется совокупностью реакций ингибитора и обозначает его антиоксидантную активность, количественно определяемой по формуле АОА = ti – tS/tS, где tS и ti – периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого антиоксиданта (АО) соответственно. Кинетику накопления гидропероксидов изучали при аутоокисленииметилолеата (МО) методом обратного йодометрического титрования в среде хлорбензола при t = (60 ± 0,2) °С. В качестве реперных ингибиторов использовали a-токоферол (a-ТФ) и дибунол, при этом концентрации АО были сравнимыми. Критическую концентрацию мицеллообразования ЦТМАБ изучали методамиРебиндера и рефрактометрическим.
Результаты и их обсуждение
Капотен представляет собой 1-[(2S)]-3-меркапто-2-метил-пропионил]-L-пролин и является тиолом. Препаратприменяют при лечении легкой и умеренной гипертонии, а также при тяжелых формах сердечно-сосудистых заболеваний. Химическая структура капотена позволяет прогнозировать его ингибирующую активность за счет восстановления гидропероксидовмеркаптогруппой или хелатирования катализатора.Впервые антиоксидантные свойства капотена были показаны в нашей работе [6]. Представляло интерес исследовать антиоксидантную активность капотена в процессе окисления метиллинолеата в условиях инициирования в среде хлорбензола и катализа в водно-эмульсионной среде.
Была изучена кинетика окисления МЛ в растворе хлорбензола в присутствии широкого диапазона концентрацийкапотена (1∙10-6–1∙10−1) М. Показано, что капотен в безводной среде проявляет сложный механизм действия, обусловленный его вероятнымучастием в реакциях обрыва, продолжения и зарождения цепей. Влияние капотена заключается в том, что при одних концентрациях происходит уменьшение максимальной скорости, при других – наблюдается промотирование процесса окисления. Из табл. 1. видно, что начальные и максимальные скорости процесса меняются экстремально: снижаются с увеличением концентрации до 1∙10-4 М (соответствует соотношению инициатора и капотена 60:1) и увеличиваются при дальнейшем её повышении.
Таблица 1
Кинетические параметры окисления метиллинолеата в безводной среде в присутствии 6∙10−3 М АИБН в зависимости от концентрации капотена, t = 60 °С
|
№ п/п |
[InH], М∙с |
t, мин |
Wнач∙10–8, М∙с–1 |
Wmax∙10–7, М∙с |
[АИБН] [InH] |
|
1 |
Контроль МЛ |
20 |
6,0 |
2,2 |
– |
|
2 |
1∙10-6 |
42 |
5,0 |
1,9 |
6000:1 |
|
3 |
5∙10-6 |
36 |
4,7 |
1,8 |
1200:1 |
|
4 |
5∙10-5 |
90 |
4,5 |
1,7 |
120:1 |
|
5 |
1∙10-4 |
44 |
4,5 |
1,7 |
60:1 |
|
6 |
5∙10-4 |
36 |
4,9 |
2,0 |
12:1 |
|
7 |
1∙10−3 |
20 |
6,0 |
2,2 |
6:1 |
|
8 |
1∙10−2 |
30 |
7,2 |
2,4 |
1:1,7 |
|
9 |
1∙10−1 |
22 |
8,0 |
2,8 |
1:17 |
Характер воздействия капотена на процесс инициированного окисления МЛ может быть объяснен его участием в радикальном процессе. Известно [7], что инициатор распадается с образованием радикалов по реакции:
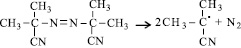
Радикал инициатора (Ri·) конкурентно взаимодействует с метиллинолеатом (RH) или с меркаптогруппойкапотена (R1SH) по реакциям:
Ri· + RH → RiH + R·
R1SH + Ri· → RiH + R1S·
Далее радикалы метиллинолеата (R·) и тиола (R1S·) взаимодействуют с кислородом по реакциям:
R· + O2 → RO2·
RO2· + RH → ROOH + R·
R1S· + O2 → R1SO2·
R1SO2· + R1SH → R1SO2H + R1S·
Наблюдаемое увеличение суммарной скорости процесса при высоких концентрациях тиола, вероятно, происходит за счет вклада более быстрого окисления тиола по сравнению с окислением жирно-кислотных компонентов липидов. Снижение максимальной скорости без торможения начальных стадий окисления при небольших добавках капотенаможет быть связано с участием соединения в реакциях продолжения цепей.
В сравнении была изучена кинетика каталитического окисления МЛ в водно-эмульсионной среде в присутствии (1∙10-6–1∙10−1) М капотена. Показано, что все добавки тормозят процесс окисления, хотя степень и характер влияния зависит от концентрации. Низкие концентрации капотена (1∙10-6–1∙10−3) М пропорционально уменьшают начальную и максимальную скорости процесса. При концентрациях 1∙10−3 М и выше происходит торможение начальных стадий процесса, увеличение периода индукции и достижение максимальной скорости процесса после выхода из периода индукции (табл. 2). Характер влияния капотена на кинетику каталитического окисления МЛ может быть объяснен следующим образом.Капотен может участвовать в реакциях обрыва цепей, обеспечивая ингибирования процесса окисления.Снижение скорости окисления под влиянием капотена может быть обусловлено его конкурентным участием с катализатором в молекулярном распаде гидропероксидов, что сказывается на снижении скорости разветвления цепей и скорости процесса в целом.
RO2· + R1SH → ROOH + R1S·
ROOH + R1SR2 → R1SOR2 + ROH
ROOH + Cu2+ → RO2· + H+ + Cu1+
Значимое торможение с последующим достижением максимальной скорости процесса начинается при соотношениях катализатора и капотена 1:1 и усиливается при соотношениях 1:5 и 1:50. Очевидно, что в этих условиях происходит нейтрализация катализатора за счет его восстановления в Cu+1. При большом избытке тиола восстановление Cu+2 в Cu+1 происходит быстрее, наблюдается эффективное торможение процесса окисления.
Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием капотена, был проведен эксперимент по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения капотена в частично окисленный субстрат(время эксперимента 8 часов). В течение первого часа наблюдалось снижение концентрации гидропероксидов, в контрольном опыте ROOH продолжали накапливаться. Установлено, что все исследуемые добавки капотена способствовали разрушению гидропероксидов на 50–75 %.
Таблица 2
Кинетические параметры окисления метиллинолеата в водно-эмульсионной среде в присутствии 2∙10−3 М CuCl2 в зависимости от концентрации капотена, t = 60 °С
|
№ п/п |
[InH], М |
t, мин |
Wн∙10–5, М∙с |
Wмак∙10–4, М∙с |
[CuCl2] [InH] |
|
1 |
Контроль |
5 |
14,4 |
2,6 |
– |
|
2 |
1∙10-6 |
8 |
7,6 |
1,6 |
2000:1 |
|
3 |
1∙10-5 |
15 |
6,9 |
1,0 |
200:1 |
|
4 |
1∙10-4 |
26 |
6,2 |
1,6 |
20:1 |
|
5 |
1∙10−3 |
45 |
3,6 |
1,7 |
2:1 |
|
6 |
1∙10−2 |
95 |
2,1 |
1,7 |
1:5 |
|
7 |
1∙10−1 |
395 |
0,6 |
1,7 |
1:50 |
Сопоставление результатов двух методов (манометрического, йодометрического) показывает, что максимальное снижение начальной и максимальной скорости окисления происходило в присутствии капотена при концентрации (1–10)∙10-4 М. Таким образом, указанные методы адекватно оценивают свойства исследуемого соединения и позволяют полагать, что разрушение гидропероксидов под действием капотена осуществлялось нерадикальным путем, поскольку вторичного инициирования процесса не наблюдалось.
Таблица 3
Кинетические параметры окисления метиллинолеатав растворе хлорбензола в присутствии 6∙10–3 М АИБН в зависимости от концентрацииa-токоферола и дибунола, t = 60 °С
|
№ п/п |
[InH], М |
t, мин |
Wнач∙10-8, М∙с–1 |
Wmax∙10–7, М∙с–1 |
|
I |
Контроль МЛ |
15 |
4,3 |
2,6 |
|
II |
a-токоферол |
|||
|
1 |
1∙10-8 |
17 |
4,3 |
2,3 |
|
2 |
1∙10-7 |
20 |
3,6 |
2,0 |
|
3 |
1∙10-6 |
35 |
2,5 |
1,9 |
|
4 |
1∙10-5 |
44 |
2,3 |
1,8 |
|
5 |
1∙10-4 |
67 |
1,1 |
1,8 |
|
6 |
5∙10-4 |
120 |
0,5 |
2,0 |
|
7 |
1∙10−3 |
350 |
0,6 |
1,7 |
|
8 |
1∙10−2 |
405 |
0,5 |
1,8 |
|
9 |
1∙10−1 |
420 |
0,2 |
1,8 |
|
III |
дибунол |
|||
|
1 |
1∙10-6 |
35 |
4,3 |
2,5 |
|
2 |
1∙10-5 |
45 |
3,4 |
2,4 |
|
3 |
2∙10-5 |
80 |
2,8 |
2,2 |
|
4 |
5∙10-5 |
140 |
2,4 |
2,2 |
|
5 |
1∙10-4 |
170 |
2,1 |
2,1 |
|
6 |
2∙10-4 |
190 |
1,9 |
2,0 |
|
7 |
5∙10-4 |
280 |
1,7 |
1,9 |
|
8 |
8∙10-4 |
590 |
1,6 |
1,9 |
|
9 |
1∙10−3 |
650 |
1,6 |
1,8 |
Для доказательства свободно-радикального механизма каталитического окисления липидного субстрата использован метод ингибиторов. Проведено исследование закономерностей окисления метиллинолеата в присутствии добавок стационарных ингибиторов окисления дибунола и a-токоферола. По результатам эксперимента рассчитаны кинетические параметры окисления субстратов.
В нашем исследовании показан идентичный характер кинетических кривых окисления метиллинолеата в растворе хлорбензола в присутствии 6∙10−3 М инициатора и водно-эмульсионной системе в присутствии 2∙10−3 М хлорида меди при равных концентрациях дибунола. Показано, что в водно-эмульсионной среде дибунол проявляет себя как сильный ингибитор: наблюдается период полного торможения, период аутоускорения и достижение максимальной скорости окисления. Периоды индукции увеличиваются пропорционально увеличению концентрации дибунола (табл. 3, 4). Наличие торможения в присутствии добавок дибунола является признаком радикально-цепного механизма процесса, а отсутствие комплексообразующей способности с катионами меди из-за экранированности двумя трет.бутильными заместителями его донорно-акцепторного центра.
По наклону прямой в координатах t, [InH] была рассчитана скорость инициирования в обеих системах, получены значения 4,8∙10-8 и 1,9∙10‒5 М∙с–1 в безводной и водно-эмульсионной среде соответственно. Сравнение максимальных скоростей окисления МЛ в безводной и водно-эмульсионной средах равных 1,3∙10-7 и 2,6∙10-4 М∙с–1 соответствует различию скоростей инициирования ~ в 1000 раз.
Известно, что a-токоферол характеризуется чрезвычайно высокой константой скорости реакции с пероксильными радикалами k7 = (3,3–3,5)∙106 М–1∙с–1, что на два порядка превышает аналогичные константы скорости для дибунола k7 = 2,6∙104 М–1∙с–1 [8]. Между тем вопрос о роли a-токоферола в биомембранах далек от своего решения. Известен сложный механизм действия a-токоферола в безводных углеводородных и липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние реакции приводят к снижению антиоксидантной активности a-токоферола. Антиоксидантную активность a-токоферола в нашем эксперименте оценивали по характеру изменения кинетических параметров по сравнению с дибунолом, для которого установлен механизм ингибирования процесса окисления в углеводородах за счет только реакций обрыва цепей [9, 10]. Анализ кинетических кривых окисления метиллинолеата показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентрации.
Таблица 4
Кинетические параметры окисления метиллинолеата в водно-эмульсионной среде в присутствии 2∙10−3 М CuCl2 в зависимости от концентрации a-токоферола и дибунола, t = 60 °С
|
№ п/п |
[InH], М |
t, мин |
Wнач∙10–5, М∙с–1 |
Wmax∙10–4, М∙с–1 |
|
I |
Контроль МЛ |
5 |
14,4 |
2,6 |
|
II |
a-токоферол |
|||
|
1 |
1∙10-8 |
10 |
14,0 |
2,1 |
|
2 |
1∙10-7 |
15 |
11,0 |
2,1 |
|
3 |
1∙10-6 |
20 |
9,7 |
1,9 |
|
4 |
1∙10-5 |
25 |
6,8 |
1,8 |
|
5 |
1∙10-4 |
35 |
5,2 |
1,4 |
|
6 |
1∙10−3 |
15 |
14,6 |
3,2 |
|
7 |
1∙10−2 |
6 |
15,7 |
3,4 |
|
8 |
1∙10−1 |
5 |
16,8 |
5,7 |
|
III |
дибунол |
|||
|
1 |
1∙10-6 |
30 |
13,8 |
2,5 |
|
2 |
1∙10-5 |
40 |
12,7 |
2,3 |
|
3 |
2∙10-5 |
75 |
9,8 |
2,1 |
|
4 |
5∙10-5 |
130 |
5,0 |
1,9 |
|
5 |
1∙10-4 |
160 |
4,1 |
1,8 |
|
6 |
2∙10-4 |
180 |
3,8 |
1,7 |
|
7 |
5∙10-4 |
270 |
3,1 |
1,6 |
|
8 |
8∙10-4 |
430 |
2,3 |
1,6 |
|
9 |
1∙10−3 |
590 |
1,9 |
1,5 |
Кинетические кривые окисления метиллинолеата в безводной среде в присутствии (1∙10-8–1∙10-5) М a-токоферола имеют аутоускоренный характер без периода полного торможения. В этом интервале концентраций начальные скорости тем меньше, чем больше добавки a-токоферола, при всех концентрациях достигается одинаковая максимальная скорость. Период полного торможения появляется только при концентрациях 1∙10-4 и 5∙10-4 М и меняется пропорционально концентрации. При дальнейшем повышении концентрации a-токоферола увеличивается начальная скорость окисления, сокращается период полного торможения, максимальная скорость достигается тем позже и при более высоких концентрациях поглощенного кислорода, чем выше концентрация a-токоферола. Результаты расчета начальной Wнач, максимальной Wmax скоростей и периода индукции приведены в табл. 3. Из табл. 3 видно сохранение близких Wmax при концентрациях a-токоферола от 1∙10-7 до 1∙10−1 М и десятикратное снижение Wнач. Представленные результаты свидетельствуют о сложном механизме действия a-ТФ в безводном растворе МЛ, об его участии не только в реакциях обрыва, но и реакциях продолжения цепей.
Было показано, что a-токоферол в ВЭС проявлял слабые антиоксидантные свойства, в концентрациях свыше 1∙10−3 М промотировал процесс окисление липидных субстратов, при концентрации1∙10-8 М a-ТФ только незначительно уменьшал максимальную скорость, без заметного влияния на начальные стадии окисления. Таким же образом влияли добавки 1∙10-7 и 1∙10-6 М a-ТФ. В присутствии 1∙10-5 и 1∙10-4 М a-ТФ наблюдалось замедление начальных стадий окисления и уменьшение максимальной скорости (табл. 4). Причиной ускорения процесса может быть комплексообразованиеOH-группы a-токоферола с катионами меди. В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [8]:
In· + RH → R· + InH
В результате этой реакции восстанавливается активная фенольная форма антиоксиданта, взаимодействующая в дальнейшем с пероксильными радикалами, ведущими цепи окисления:
RO2· + InH → ROOH + In·
Полученные данные могут представлять интерес с точки зрения расширения спектра фармакологического действия капотена и быть методологической основой для разработки новых подходов оценки взаимодействия антиоксидантов с компонентами клетки.
Выводы
1. Установлено, что синтетический ингибитор окисления дибунол в двух кинетических моделях в безводной и водно-липидной средах превосходит по своему действию природный антиоксидант a-токоферол.
2. Выявлена высокая антиоксидантная активность капотена в водно-липидных катализируемых субстратах, превышающая ингибирующие свойства a-токоферола и уступающая активности дибунола.
3. Установлено, что капотен в процессе окисления разрушаетгидропероксиды молекулярным путем. Вероятно, что способность разрушения гидропероксидов капотеном связана с наличием меркаптогруппы.

