Современные технологии позволяют использовать различные конструктивные методы лечения с целью реконструкции скомпрометированного зубо-челюстного аппарата, как в части вторичной адентии, так и дефицита кости. Идеальным стандартом для ремоделирования челюстной кости, утраченной вследствие инволютивной атрофии, травмы или пародонтита, является комбинация аутогенной и аллогенной трансплантации [1]. При небольших объемах ремоделирования наиболее часто в качестве донорской зоны используется подбородочный симфиз как наиболее оптимальная зона в гистологическом, анатомо - структурном и организационном отношении. Однако конечный результат остеорегенерации может быть не достигнут вследствие развития неадекватного воспалительного ответа. Одним из маркеров, отражающих потенциал неспецифической иммунологической защиты, является состояние нейтрофильных гранулоцитов (НГ) [3,5,6]. НГ первыми из иммунокомпетентных клеток мигрируют в очаг повреждения, независимо от его асептической или инфекционной природы, с предназначением распознавания, связывания и элиминации чужеродного антигена [4,8,9,10]. НГ являются не только клетками – "камикадзе". Они обладают полноценными иммунорегуляторными свойствами, способны к экспрессии генов и синтезу цитокинов с запуском при необходимости всего иммунологического механизма [4,9,10]. Интегральным показателем микробицидного и цитотоксического потенциала НГ может быть состояние ядерного хроматина НГ и уровень цитоплазматических полимеров. Снижение уровня оптической плотности ядерного хроматина свидетельствует о явлениях его деспирализации (реструктуризации), сопровождающихся ослаблением химических связей комплекса ДНК-гистон в ядрах клеток [7;8]. Подобные явления указывают на биологическую активацию хроматина, матричной активности ДНК, последующего белкового синтеза и в целом функциональной активности НГ. Однако, несмотря на ряд проведенных исследований [4;5], данная концепция в целом и применительно к челюстному остеогенезу de novo нуждается в дополнительных клинических фактах ее подтверждения.
Цель исследования: разработать предиктор раннего постоперационного течения остеотрансплантации путем изучения цитохимических особенностей НГ раневого экссудата у больных с благоприятным и пролонгированным течением флегмон челюстно-лицевой области и у пациентов, нуждающихся в костной трансплантации.
Материалы и методы исследования
Материалом служили мазки-отпечатки раневого экссудата у больных с флегмонами челюстно-лицевой области (1гр. – 60 пациентов) и крови из реципиентской зоны трансплантации (2гр. – 25 человек). Флегмоны челюстно-лицевой области (ФЧЛО), захватывающие 2-3 клетчаточных пространства, одонтогенной природы характеризовались среднетяжелым типичным неосложненным течением. Больные получали стандартное общее и местное противовоспалительное лечение, вскрытие гнойного очага осуществлялось традиционным подходом. Больные 1гр. дифференцировались на 2 подгруппы. Критерием разделения - благоприятное и пролонгированное течение - служил срок наложения вторичных швов (НВШ). 1.а.гр. составили 30 пациентов, НВШ которым проводили до 7 суток. 1.б.гр. (30 человек) - пациенты, НВШ у которых проводили в срок, превышающий 7 суток. Пациенты 2.гр. были соматически здоровы, без отягощающего анамнеза. Атрофия челюстной кости была обусловлена резорбцией альвеолярной кости. Локальный стоматологический статус предполагал санированную полость рта, отсутствие воспалительных явлений. Донорской зоной служил подбородочный симфиз. Из донорского трансплантата готовился расщепленный блок, который фиксировался титановыми винтами к реципиентной зоне. Отсутствие объемной конгруэнтности компенсировалось микстом из измельченной оставшейся губчатой кости и синтетического остеопластического материала "Osteon II" с величиной гранул 0,25 – 0,5 мкм. Операционная рана укрывалась биодеградируемой мембраной "Collagen membrane", которая адаптировалась к поверхности и иммобилизовалась. Костный дефект донорской зоны также возмещался "Osteon II" и закрывался резорбируемой мембраной "Collagen membrane". Для предотвращения натяжения слизисто-надкостничного лоскута последний мобилизовался путем рассечения надкостницы. Операционная рана реципиентной зоны ушивалась фторполимерной нитью – "Гортекс", донорская зона - ПГА. Забор цитологического материала у больных 1гр. проводили трижды – в момент вскрытия ФЧЛО, на третьи сутки от начала лечения и во время НВШ, а также в момент выкраивания слизисто-надкостничного лоскута в области реципиентной зоны. Клиническое наблюдение больных 2гр. в рамках проведения данного исследования проводилось ежедневно до снятия операционных швов и дискретно на всех этапах неоостеогенеза (рис. 1,2).
|
А |
Б |
|
В |
Г |
|
Д |
Е |
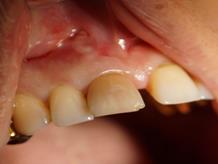
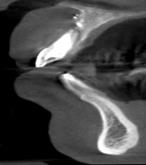
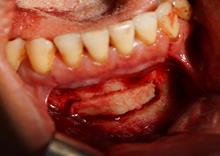
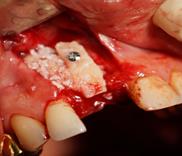
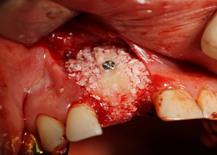
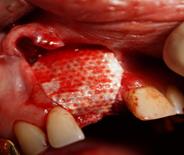
Рис. 1. Этапы ремоделирования кости в области 11 зуба с целью дентальной имплантации
(А – 11 зуб неоднократно лечен, подвижность 2-3 степени, перкуссия безболезненна, в проекции верхушки корня зуба пародонтальный абсцесс со свищевым ходом; Б – на КЛКТ – деструкция кости в области корня 11 зуба, перфорация корня, остатки пломбировочного материала; В – скелетирована области симфиза, по протоколу подготовлен для забора костный донорский материал; Г – произведено расщепление костного блока, кортикальная часть которого фиксирована винтом к реципиентному месту; Д – микстом из аллогенной и аутогенной кости ремоделирована кость в области одномоментно удаленного 11 зуба; Е – использована техника направленной регенерации кости – ремоделированная область закрыта резорбируемой мембраной)
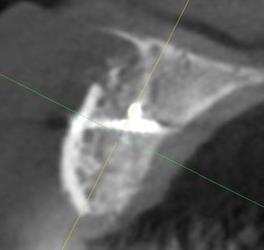
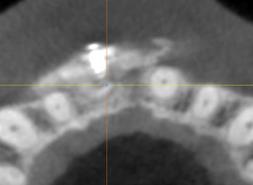
Рис. 2. КЛКТ зоны неоостеогенеза через 6 месяцев
Для определения уровня реструктуризации хроматина НГ мазки-отпечатки раневого экссудата и крови операционной раны наносили на обезжиренные предметные стекла, фиксировали ацетон-этанолом (соотношение 1:1) и парами 40% формалина по 15 и 5 мин соответственно, окрашивали толлуидиновым синим при рН-5,0, а также по Фельгену на ДНК, окрашенные отпечатки, подвергали абсорбционной фотометрии на установке ФЭМЛ-1а (ЛОМО) методом двух площадей по Гарсиа (1969) [2] при длине волны 530 нм, катионный белок (КБ) выявляли по Пигаревскому В.Е. (1975), миелопероксидазу (МП) по Sato J. и Selkija С. (1928), гликоген (Г) по Pearse A.G.E. (1961). Изучение уровня оптической анизотропии проводили с помощью поляризационного микроскопа МП-8 полуколичественным методом Astaldi G. и Verga L. (1957), модифицированным для исследования клеточного ядра [3]. Полученные результаты цитохимических исследований у больных после проведенных костных трансплантаций хранились в зашифрованной форме до полного окончания периода остеогенеза. После чего общая кагорта пациентов 2гр. была дифференцирована на 2 подгруппы. С оптимальным течением ранозаживляющего процесса – 2.а.гр., у которых операционные швы снимали в срок до 8 суток и 2.б.гр., у которых операционные швы снимали соответственно позже. После чего вскрывалась зашифрованность исследования, проводился анализ и обработка полученных данных. Все результаты обрабатывали методами вариационной статистики с использованием программы “Statistica-6”.
Результаты иссдедований
и их обсуждение
Постоперационный период после вскрытия ФЧЛО был удовлетворительным в обеих группах. На следующие сутки после операции больные были активны, могли самостоятельно передвигаться по отделению и принимать пищу, для них был характерен стабильный гемодинамический профиль. Однако в 1.а.гр. сроки сохранения инфильтрации, экссудации и время появления молодых грануляций в ране были значительно короче. Явные общие и местные клинические признаки стабилизации и купирования гнойного процесса, превалирование пролиферативных процессов в ране над альтеративными позволили уже через 5,84±0,72 сут производить НВШ. В 1.б.гр. НВШ осуществлялось в среднем через 10,76±1,33 суток (p<0,05). Средняя длительность пребывания в стационаре больных 1.а. группы составила 102,7±2,42 сут., 1.б.гр. - 17,6±1,83 сут. (р<0,05).
У больных 1.б.гр., у которых наблюдался более пролонгированный период до НВШ, по сравнению с 1.а.гр., было выявлено достоверное перманентное увеличение уровня цитоплазматических биополимеров и снижение активности хроматина ядра к 3 суткам курации и к НВШ. Активность структуризации хроматина НГ соответственно срокам исследования составила 1,31+0,09; 1,23+0,06 (P<0,05) и 1,28+0,08 усл.ед. (P>0,05). При этом содержание КБ соответственно равнялось 1,7+0,05; 2,11+0,03; 2,98+0,4 усл.ед. (P<0,01) соответственно. Содержание Г в описанные сроки составило 1,51+0,12; 2,03+0,07; 2,82+0,05 усл.ед. (P<0,01) соответственно. Активность МП - 0,95+0,04; 1,4+0,04; 1,9+0,06 усл.ед. (P<0,01). Выявляемость ДНК НГ, окрашенных по Фельгену распределилась по срокам следующим образом: 0,81+0,001; 0,67+0,002 и 0,48+0,001 усл.ед. (P<0,01) соответственно.
Изучение уровня оптической плотности хроматина ядер НГ раневого экссудата у больных 1.а.гр. показало, что он снижался к 3 суткам наблюдения, вновь увеличивался к НВШ и составил. Содержание КБ - 1,4+0,11; 0,87+0,14; 1,96+0,18 усл.ед. (P<0,01). Содержание Г в описанные сроки равнялось 1,54+0,12; 1,43+0,07; 1,99+0,05 усл.ед. (P<0,001). Активность МП изменялась аналогичным образом и составила 0,91+0,08; 0,6+0,05; 1,6+0,06 усл.ед. (P<0,001). Выявляемость ДНК НГ, окрашенных по Фельгену распределилась по срокам следующим образом: на момент вскрытия она оказалась равной 0,78+0,01 усл.ед., через трое суток она равнялась 0,96+0,002, на момент НВШ - 0,87+0,001 усл.ед. (P<0,001).
Следовательно, у больных с явной тенденцией к быстрому выздоровлению уже на третьи сутки после вскрытия гнойного очага в цитоплазме НГ снижается содержание КБ, МП и Г, что отражает усиление их расхода, и существенная деспирализация хроматина НГ. Ослабление химических связей комплекса ДНК-гистон в ядрах НГ свидетельствует об усилении матричной активности ДНК с целью компенсации повышенного расхода белкового синтеза. Обнаруженные процессы, по-видимому, неразрывно связаны с функциональной активностью НГ и благоприятным исходом заболевания. В дальнейшем по мере снижения экссудативных явлений и очищения раны описанные эффекты становятся менее выраженными, однако, даже в период НВШ, НГ экссудата остаются частично активированными, о чем свидетельствует в большей степени окраска по Фельгену на ДНК. При этом величина содержания КБ, Г, активность МП восстанавливаются и даже превышают уровень, обнаруженный при вскрытии гнойного воспалительного очага. Пролонгированное разрешение гнойного процесса было ассоциировано со сниженной активностью ядерного хроматина, меньшим расходования КБ, МП и Г.
Разнонаправленная, но взаимосвязанная динамика цитохимических показателей ядра и цитоплазмы НГ у больных 1.а. и 1.б. групп, предопределила необходимость получения представления об интегральной характеристике функциональной активности НГ раневого экссудата при ФЧЛО. С этой целью нами был разработан тканевый индекс нейтрофильных гранулоцитов (ТИНГ). Последний выражается в условных единицах и определен как отношение интенсивности окрашиваемости ДНК к сумме концентраций КБ, Г и активности МП, выявляемых при фотометрии в единицах оптической плотности: ТИНГ=(ДНК/(КБ+МП+Г))*1000, где 1000 - коэффициент, для удобства преобразующий тысячные доли в целые числа. Правомерность такого подхода к определению интегральной функциональной активности клеток закономерно вытекает из классического правила Гертвига - ядерно-цитоплазматического соотношения [17]. При использовании данного коэффициента интегральная активность НГ раневого экссудата у больных с благоприятным типом течения ФЧЛО, составила при вскрытии флегмоны 202,07 усл. ед.; на 3-и сутки - 331,03 усл. ед.; при НВШ - 156,76 усл. ед. У больных 1.б. группы - соответственно 193,78 усл. ед., 121,60 усл. ед. и 62,34 усл. ед. Следовательно, интегральная величина общей биологической активности тканевого пула НГ, отражающая активацию хроматина НГ и сопровождающаяся усилением расходования микробицидных компонентов их цитоплазмы и повышением расхода энергетических запасов клетки, может служить предиктором благоприятного прогноза постоперационного течения. Данный тезис был подтвержден у пациентов на этапах остеотрансплантации и неоостеогенеза.
Группа больных (2.б.гр.) со сроком снятия операционных швов более 8 суток составила 7 (28%) человек, что было обусловлено наличием выраженной гиперемией и отеком околораневых тканей. Из-под линии швов определялась серозно-геморрагическая экссудация в умеренном объеме. У 2х больных (8%) характер серозной экссудации сменился на гнойный, что потребовало введение мягких дренажей. Воспалительные явления сопровождались жалобами пациентов на болезненные ощущения в области реципиентной зоны трансплантации, дискомфорт, повышение температуры. Особенностей в течение раневого процесса в области донорской зоны выявлено не было. Всем больным 2.б. группы был назначен курс антибиотикотерапии, нестероидные противовоспалительные препараты, увеличена частота антисептической обработки. Операционные швы у всех больных были состоятельны вплоть до момента их снятия. Местное и общее противовоспалительное лечение позволило купировать ранние воспалительные проявления и обеспечить дальнейший адекватный остеогенез. Величина ТИНГ во 2.а. группе в интраоперационном периоде оказалась равной 224,12 усл. ед., в группе 2.б. – 106,24 усл. ед. Диапазон временного интервала до снятия швов во 2.б. группе составил от 9 до 15 дней и коррелировал с отрицательной корреляционной связью с величиной ТИНГ (КК=-0,67).
Заключение
Таким образом, величина ТИНГ, отражающая интегральную биологическую активность тканевого пула НГ, может служить предиктором раннего постоперационного течения, в частности, при планировании общего объема хирургического протокола костнопластических операций.