В настоящее время запасы марганцевых руд в России невелики и их разработка осуществляется лишь в незначительных количествах, поэтому марганец в России стал одним из остродефицитных компонентов сталеплавильного производства. В связи с этим, как одним из вариантов решения данной проблемы может стать процесс извлечения его из техногенных вод ГОКов Южного Урала [3, 9].
С целью рассмотрения возможности селективного извлечения ионов марганца (II) из кислых рудничных вод нами был исследован процесс извлечения его путем окислительно-восстановительного осаждения в виде осадка MnО2 с использованием в качестве реагента-окислителя раствора гипохлорита натрия, полученного электрохимическим путем из водных растворов NaCl [4, 5].
Проведённые исследования показали, что более полное извлечение ионов марганца (II) из раствора в виде осадка окислительно-восстановительным осаждением наблюдается в интервале рН системы от 4,5 до 10,5 (рис. 1).
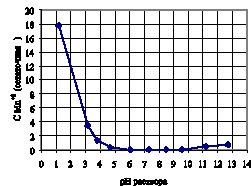
Рис.1. Влияние рН системы на полноту извлечения Mn марганца в виде осадка МnО2
Однако, с учетом того, что при электролизе водного раствора хлорида натрия на аноде может образовываться несколько активных формы хлор-содержащих окислителей: Сl2, НОСl, ОСl-, обладающих различной окислительной способностью, необходимо выявление более узкого интервала рН системы, при котором полное количественное извлечение ионов Мn (II) в виде осадка МnО2 будет протекать с большей скоростью при минимальном расходе реагента-окислителя [3, 4].
Наиболее полно свойства растворов хлора и его кислородных соединений изучены группами ученых под руководством профессоров Флиса И.Е. и Тумановой Т.А. [7, 8]. Они установили, что участниками окислительных процессов могут быть все компоненты растворов кислородных соединений хлора. Доля же участия этих компонентов в окислительных процессах зависит от рН раствора и природы восстановителя. Показано, что реакции, протекающие в растворах «активного хлора», относятся к типу реакций, катализируемых в слабокислой и нейтральной средах ионами Н+ и ОН-. Причем, ионы Н+ и ОН- в окислительно-восстановительных реакциях могут быть и участниками процесса, и его катализаторами. В среде, близкой к нейтральной, не катализируемых реакций нет. Кроме того, реакции, протекающие в растворах гипохлоритов, следует отнести к типу реакций общего кислотно-основного катализа, т.к. НСlО и СlО- являются сопряженными кислотами и основанием [2,3]::
НСlО + H2O ↔ Н3О+ + СlО−
СlО− + H2O ↔ НСlО + ОН−
Следует учитывать, что в щелочной среде катализ ионами Н+ и ОН- отсутствует, а подвижность ионов СlО− значительно меньше в щелочной среде, чем в кислой и нейтральной. В растворах кислородных соединений хлора окислительные процессы обусловлены действием атомарного кислорода, образующимся в результате разложения «активного хлора» при взаимодействии с восстановителями (в качестве восстановителей могут выступать катионы металлов – Mn2+, Fe2+ и др.): НСlО → НСl + О ٠
В чистых растворах гипохлоритов реакция сопровождается образованием хлоратов. Образование кислорода в результате разложения НСlО термодинамически менее вероятно, чем такой же процесс разложения ионов СlО-. При совместном присутствии в растворе хлорноватистой кислоты и гипохлорит-иона разложение их с образованием атомарного кислорода термодинамически более вероятно, чем процесс образования кислорода в результате разложения одного из компонентов [7, 8].
В нейтральной и слабокислой средах разложение «активного хлора» происходит по следующему механизму:
НСlО + СlО- → О2 + 2Сl- + H+
НСlО + 2СlО- → СlО3− + 2Сl- + H+
В кислой среде разложение идет по следующим реакциям:
НСlО → О2 + 2Сl- + 2H+
3НСlО → СlО3− + 2Сl- + H+
Прокопчиком А.Ю. [6] разложение гипохлорита в щелочной среде также рассматривается постадийно из двух последовательных реакций хлорид-хлоратного типа:
СlО− + СlО− ↔ СlО2− + Сl-
СlО2− + СlО− ↔ СlО3− + Сl-
и хлорид-кислородного типа:
СlО− + СlО− ↔ 2Сl− + О2
Самоокисление гипохлоритной системы и образование хлората − сравнительно медленный процесс. Условия, при которых разложение гипохлорита с образованием кислорода значительно ускоряются, приводят к быстрому уменьшению концентрации тех составляющих, окисление которых ведет к образованию хлората [7].
Ряд авторов указывают, что в присутствии гидроксидов металлов переменной валентности процесс каталитического разложения может протекать с образованием свободных радикалов СlО٠, CI٠, ОН٠, Н٠, неустойчивость которых может вызывать цепные реакции. В образовании радикалов участвуют как хлорноватистая кислота, так и гипохлорит- ион [2].
Активные радикалы СlО٠ могут способствовать реакциям образования атомарного кислорода, и ОН٠радикала:
2СlО− + СlО٠ + ОН− → ЗСl– + ОН٠ + 3/2 О2
(процесс, определяющий скорость разложения гипохлорита)
ОН− + ОН٠ → Н2О + О٠
(быстрый процесс выделения атомарного кислорода)
ОН٠ + СlО− → СlО٠ + ОН–
(менее вероятный процесс продолжения побочного развития цепи в сильнощелочной среде).
При очистке сточных вод «активным хлором» без катализаторов следует рассматривать соотношение трех процессов: саморазложения, окисления органических загрязнений (R – общий окисляемый комплекс) и образования хлорированных продуктов исходных или низкомолекулярных соединений. Поэтому, расход «активного хлора» может распределяться следующим образом:
саморазложение – хлорат, хлорид, кислород
окисление – R + «активный хлор» → Rокис. + CI–
(образование низкомолекулярных продуктов)
образование – R + «активный хлор» → Rокис х CI٠ +
хлорпроизводных + хлорированные низкомолекулярные продукты
Процесс саморазложения «активного хлора», характеризующийся образованием хлоратов, происходит только в чистых растворах «активного хлора» и в присутствии трудноокисляемой органики. Самое интенсивное окисление происходит в слабокислой, нейтральной и слабощелочной средах [6, 7].
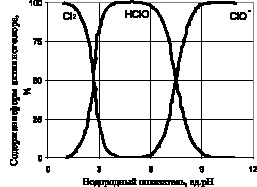
Рис. 2. Содержание форм активного хлора в растворе при различных значениях рН
При участии катализаторов, в процессе восстановления «активного хлора» до хлоридов восстанавливаться могут даже хлораты [6]. Поэтому можно предположить, что атомарный кислород можно получить каталитическим разложением «активного хлора» во всем диапазоне рН, в котором хлор находится в в виде кислородных соединений (рис. 2).
Реакции с участием кислорода также зависят от кислотности среды. В щелочной среде скорость переноса кислорода в 50 раз меньше, чем в нейтральной и слабокислой средах, что отражается на процессе окисления [6]. Этим объясняются выводы ряда авторов о том, что окислительные процессы в гипохлоритных растворах протекают с участием хлорноватистой кислоты. При рассмотрении работ данных авторов можно констатировать, что окислительный процесс в растворах протекает с участием преимущественно хлорноватистой кислоты. Во многих случаях процесс окисления происходит с разложением «активного хлора» на атомарный кислород и хлорид-ион. Атомарный кислород участвует в окислительном процессе, а ион Сl– остается в растворе.
В данной работе не ставилась задача экспериментального подтверждения этих положений, нами сделаны только некоторые обобщения применительно к процессу окислительно-восстановительного осаждения ионов марганца (II) с образованием дисперсной фазы диоксида марганца, позволяющие выбрать направление исследований по интенсификации окисления ионов Mn (II).
На основании результатов представленных выше очевидно, процесс окислительно-восстановительного осаждения ионов марганца (II) до нерастворимых форм Mn (IV) будет протекать с большей скоростью при минимальном расходе реагента-окислителя в диапазоне рН от 7,0 до 7,6.

