Еще К.Э. Циолковский писал «... мы, земные жители, ... мечтаем о межпланетных путешествиях...» [9]. Несмотря на сложность проблемы, стоящей перед человечеством, по словам К.Э. Циолковского «... эта задача может быть решена. Решение основывается на особом приеме изучения людей» [10].
Сохранение механической продукции мышц зависит от физической нагрузки и, в частности от гравитационной нагрузки, но когда этот фактор полностью удален, как например во время космического полета [11, 14, 35, 43] или частично снижен, как в моделях, моделирующих эффекты микрогравитацию, таких как, иммобилизация [36], «вывешивание» нижней конечности [11, 15, 21], постельный режим [12, 13, 38, 45], то наиболее чувствительными к изменению сниженных механических нагрузок, оказываются антигравитационные мышцы типа мышц-разгибателей бедра и стопы, но больше стопы [3, 12, 22], вероятно из-за большей их механической нагрузки в гравитационных условиях Земли. Самая очевидная адаптация скелетных мышц к снижению или полному удалению весовой нагрузки, способствующей уменьшению механической продукции, это снижение массы и потеря мышцы, что проявляется в уменьшение ее размера [12, 13, 34]. Однако при разгрузке отмечается большая потеря силы сокращения и мощности, развиваемой мышцей, чем уменьшения ее размера/объема [13, 14, 15] и одновременно отмечается снижение нервной активности [14, 24, 40] и мышечно-суставной жесткости [5, 21, 33, 35, 39].
Сниженная функция мышц во время продолжительного космического полета может подвергнуть опасности не только здоровье члена экипажа, но и успех всей экспедиции, ограничивая выполнение операторской работы.
Для имитации физиологических эффектов длительной невесомости в условиях Земли используют модель антиортостатической гипокинезии [2, 19].
Целью настоящей работы было исследовать нейро-мышечную адаптацию отдельной скелетной мышцы у человека в условиях in situ после пребывания в условиях 60-суточной антиортостатической гипокинезии. В качестве объекта изучения были выбраны параметры механических ответов ТМГ, являющейся постуральной, антигравитационной мышцей [17].
Методика
Испытуемые. В исследовании приняли участвие группа (n = 6) добровольцев-мужчин, которые на протяжении эксперимента находились на строгом постельном режиме. Антропометрическая характеристика испытуемых представлена в таблице.
Антропометрическая характеристика испытуемых
|
№ п/п |
Возраст (лет) |
Масса тела (кг) |
Рост (см) |
|
1 |
23 |
78 |
178 |
|
2 |
27 |
81 |
181 |
|
3 |
25 |
64.5 |
177 |
|
4 |
30 |
63 |
176 |
|
5 |
42 |
115 |
190 |
|
6 |
38 |
77 |
186 |
|
M ± m |
30.8 3.1 |
79.8 7.7 |
181.3 2.3 |
Отбор испытуемых базировался на анализе медицинской истории болезни, общего анализа крови, мочи, электрокардиограммы (в покое и при физической нагрузке), биохимического анализа крови, включая анализ глюкозы (натощак), содержание азота в мочевине крови, креатинина, молочной кислоты, билирубина, мочевой кислоты и холестерина, а также оценки физического состояния при выполнении нагрузочного теста на велоэргометре при постоянной частоте педалирования 60 об/мин и с начальной нагрузкой 50 Вт в течение 3 мин. Нагрузка последующих «ступеней» повышалась на 25 Вт и критерием прекращения работы было достижение субмаксимальной величины частоты сердечных-сокращений.
Все испытуемые клинически были оценены как здоровые и отличались относительно высокой устойчивостью к ортостатической нагрузке, без признаков заболеваний мышечной системы и находились в хорошем физическом состоянии и имели нормальное нервно-психическое развитие. Все испытуемые во время исследования испытуемые не принимали медикаментозных средств и были некурящими.
Во время предварительного посещения лаборатории испытуемые были проинформированы о целях и методах исследования, подробно ознакомлены с процедурами исследования произвольных и электрически вызванных сокращений мышц. После этого каждый испытуемый подписал информированное согласие на участие в эксперименте в качестве обследуемого.
Все экспериментальные процедуры были выполнены в соответствии с Хельсинской Декларацией 1975 г. по правам человека на участие в эксперименте в качестве испытуемого и программа исследований была одобрена комиссией по биомедицинской этике при Институте медико-биологических проблем РАН.
Постельный режим. В качестве модели, имитирующей длительное влияние фактора невесомости, использовали модель антиортостатической (угол наклона головы –6°) гипокинезии (АНОГ) постельного режима [2, 18]. Длительность механической разгрузки мышечного аппарата составляла 60 суток. Испытуемые постоянно оставались в антиортостатическом положении, включая прием пищи и гигиенические процедуры. Во время экспозиции на протяжении 24 ч испытуемые постоянно находились под контролем медицинского персонала и дополнительно проводился мониторинг поведения испытуемых. Обслуживающий медицинский персонал присутствовал при транспортировании испытуемого, при выполнении личной гигиены, включая прием пищи, медицинском обслуживании в пределах протокола.
Измерительная аппаратура. Измерение сократительных свойств ТМГ было выполнено с использованием тендометрического динамометра. Динамометр и используемая система регистрации произвольной и электрически вызванной силы сокращения ТМГ был предварительно подробно описаны ранее [5].
Сократительные свойства ТМГ измерялись дважды – за ~ 10-8-суток до начала постельного режима и на 3-сутки после его окончания. Протокол испытаний сократительных функций ТМГ до и после постельного режима был идентичным.
Стимуляция. Для стимуляции n. tibialis применяли универсальный нейро-мышечный стимулятор (тип «ЭСУ-1», СССР) с изолирующей приставкой. Использовали монополярный электрод – активный электрод (катод, стальной шарик Ø 1 см) устанавливали под коленной ямкой (место наименьшего сопротивления), а пассивный (анод, Ag/AgCl пластина 6 х 4 см) – на нижней трети передней поверхности бедра. Положение стимулирующих электродов подбирали так, чтобы при некоторой «минимальной» силе раздражения регистрировать (по электромиографическому залпу m. soleus) наибольший прямой ответ мышцы (М-ответ). В дальнейшем силу раздражения увеличивали в 1,5-2 раза, что позволяло использовать супрамаксимальную силу раздражения (сила на 30-40 % больше той «минимальной» силы, при которой впервые достигается максимальный Мответ).
Электромиограмма. Для регистрации поверхностной электромиограммы (ЭМГ) биполярные Ag/AgCl электроды (Ø 8 мм; межэлектродное расстояние 25 мм) были помещены по средней линии брюшка камбаловидной мышцы на уровне ниже 2 см головок икроножных мышц. Электроды были заполнены электродным гелем для лучшего электрического контакта с кожей. Дополнительно для уменьшения межэлектродного импеданса до 5 kW поверхность кожи в месте установки Ag/AgCl электродов обрабатывалась абразивной пастой и протиралась раствором спирта с эфиром. Электрод заземления (Ag/AgCl пластина размером 7.5 х 6.5 см) был помещен в проксимальной части голени между отводящими и раздражающим электродами. Для усиления сигнала ЭМГ использовали усилитель с частотной полосой от 0.01 до 10 кГц и с выносным катодным повторителем (тип «УБП-1-02», СССР). Усиленный сигнал визуально контролировали на экране запоминающего осциллоскопа (тип «С8-9А», СССР) и синхронно регистрировали на светолучевом осциллографе (тип «К-115», СССР).
Процедура. Сократительные свойства ТМГ оценивали по механическим параметрам произвольного и электрически вызванных (непроизвольных) сокращений. Экспериментальный протокол состоял из трех частей.
1. При выполнении произвольного изометрического сокращения ТМГ испытуемого инструктировали как реагировать на звуковой сигнал – «сократить мышцу как можно сильнее». Во время выполнения задания испытуемому сообщалась величина развиваемого произвольного усилия и разрешался зрительный контроль за развиваемым усилием по часовой стрелке динамометра. Каждый испытуемый выполнял от 3 до 4 попыток отделенных периодом отдыха не менее 1 мин и наибольшая величина в одной из попыток принималась за показатель максимальной произвольной силы (МПС).
Непроизвольные изометрические сокращения (одиночные, парные и тетанические) ТМГ вызывали электрическим раздражением n. tiblalls, используя нейро-мышечный электростимулятор.
Амплитуда сокращения мышцы в ответ на одиночный электрический импульс супрамаксимальной силы, приложенный к n. tibialis, являлась показателем изометрической силы одиночного сокращения (Рос) (рис. 1, левая панель), а при тетанической ритмической стимуляции (частота 150 имп/с) – показателем максимальной силы (Ро) сокращения ТМГ (рис. 1, правая панель). Для количественной оценки степени совершенства центрально-нервных координационных механизмов управления произвольным движением рассчитывали величину силового дефицита (Рд) [5], определяемую как дельта между Ро и МПС (рис. 1, правая панель).
Для определения «внутренней» силы сократельных элементов мышцы использовали раздражение парное раздражение, когда второй электрический импульс подавали с интервалом в 3, 4, 5, 10, 20 и 50 мс после первого [5] и определяли максимальную амплитуду второго (суммированного) механического ответа ТМГ.
2. По тендограмме изометрического Рос ТМГ (рис. 1, левая панель) рассчитывали время от момента нанесения электрического стимула (артефакт раздражения) до пика Рос (время одиночного сокращения – ВОС), время от пика Рос до половины расслабления (время 1/2 ПР) и общее время сокращения (время от момента нанесения электрического стимула до полного расслабления – ОВС). Точность измерения составила – 2 мс.
3. Каждого испытуемого тщательно инструктировали, как реагировать на звуковой сигнал – «сократить мышцу максимально быстро и сильно». Регистрируемое произвольное сокращение ТМГ принималось как «взрывное» баллистическое сокращение. В кривой сила–время определяли время достижения силы сокращения до уровня в 25, 50 75 и 90 % от МПС [5] (рис. 1, правая панель). Аналогично по тендограмме электрически вызванного сокращения при стимуляции n. tibialis с частотой 150 имп/с [5] определяли время нарастания электрически вызванного сокращения (рис. 1, правая панель).
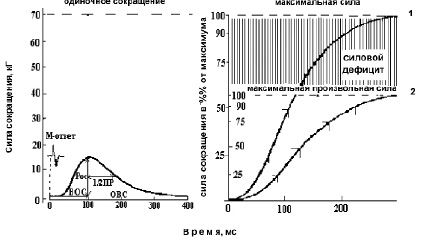
Рис. 1. Пример развития изометрического одиночного сокращения (левая панель), тетанического электрически вызванного и произвольного сокращения ТМГ у человека (правая панель)
Примечание. ВОС – время одиночного сокращения, 1/2 ПР – время полурасслабления, ОВС – общее время сокращения, Рос – сила одиночного сокращения.
Максимальную скорость развития произвольного (dPпс/dt) и электрически вызванного тетанического сокращения (dPтс/dt) определяли путем дифференцирования механических (аналоговых) ответов мышцы.
Статистика. При обработке полученных результатов исследования использовали общепринятые статистические методы: рассчитывали среднюю и стандартную ошибку средней (М ± m). Различие между фоновыми (контрольными) показателями и показателями, зарегистрированными после 60-суточного жесткого постельного режима, оценивали с помощью параметрического t–критерия Стьюдента и величину значения р < 0.05 принимали как существенную.
Результаты
Фоновые исследования сократительных свойств ТМГ показали, что изучаемые функции мышечного сокращения находились в пределах физиологической нормы, и по своим функциональным возможностям все обследуемые могли быть охарактеризованы как практически здоровые люди, ведущие обычный двигательный образ жизни.
Исследования, выполненные после жесткого 60-суточного постельного режима, выявили, прежде всего, общую однонаправленность изменений тестируемых сократительных свойств мышцы.
Анализ данных изменений силовых свойств ТМГ после пребывания в условиях 60-суточной АНОГ, обнаружил достоверное снижение силы сокращения мышцы (рис. 2, верхняя панель). Так, изометрическая Рос уменьшилась в среднем на 17.3 % (до 12.7 ± 0.8 кг после 10.5 ± 1.1 кг; p < 0.05); МПС – на 33.5% (до 52.6 ± 4.3 кг после 35.0 ± 3.8 кг; р < 0.05) и Ро – на 18.0,% (до 68.8 ± 5.3 кг после 56.4 ± 5.3 кг; р < 0.05).
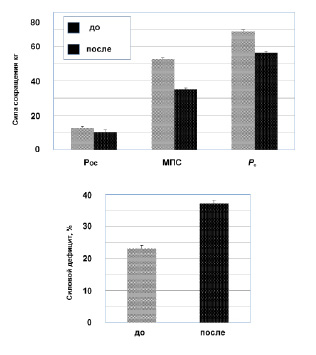
Рис. 2. Влияние 60-суточной АНОГ на силу одиночного сокращения (Рос), максимальную произвольную силу (МПС), максимальную силу (Ро) сокращения ТМГ (верхная панель) и на величину силового дефицита (нижняя панель)
МПС ТМГ как до, так и после экспериментальных воздействий была постоянно меньше, чем Ро мышцы, и составила в среднем 78.5 и 62.8 % (p < 0.001) от Ро. Таким образом, величина силового дефицита (Рд), указывающая на степень совершенства центрального звена управления мышечным аппаратом, составляла в фоновых исследованиях в среднем 23.1 ± 4.8 %, а после экспериментальных воздействий – 37.2 ± 6.6 % (p < 0.001) (рис. 2, нижняя панель).
Анализ динамики изменения изометрической силы ТМГ при парной стимуляции двигательного нерва супрамаксимальной интенсивностью, когда второй стимул наносился через 3, 4, 5, 10, 20, 50 мс после первого, показал, что наибольшая сила сокращения ТМГ до АНОГ отмечается при интервалах между импульсами 4-10 мс, а после АНОГ – 420 мс и уменьшение или увеличение интервалов между указанными импульсами сопровождается уменьшением силы (p < 0.05), не изменяя общей тенденции развития напряжения мышцы (рис. 3). Одновременно изменялся характер расположения кривых при одном и том же межимпульсном интервале: относительный прирост силы сокращения ТМГ на второй импульс различался до и после АНОГ – наибольший он был после АНОГ по сравнению с исходной величиной (p < 0.001).
Скоростные свойства. Анализ данных изменений среднего времени развития изометрической Рос ТМГ после АНОГ не обнаружил значимых изменений ВОС ТМГ (до 145.3 ± 2.3 мс после 140.3 ± 2.2 мс) (рис. 4).
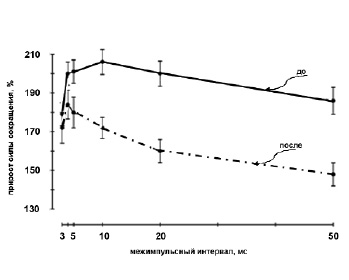
Рис. 3. Влияние АНОГ на зависимость максимальной силы сокращения (% амплитуды парного раздражения) от межимпульсного интервала
Примечание. ВОС – время одиночного сокращения; 1/2 ПР – время полурасслабления; ОВС – общее время сокращения.
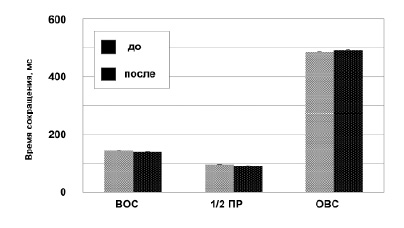
Рис. 4. Изменение максимальной силы изометрических сокращений ТМГ при парном раздражении с разными межимпульсными интервалами под влиянием 60-суточной АНОГ
1/2 ПР ТМГ после АНОГ уменьшился в среднем на 7.2 % (до 97.0 ± 1.1 мс после 90.0 ± 6.8 мс; p < 0.050.01). ОВС ТМГ увеличилось в среднем на 1.3 % (до 486.0 ± 17.7 мс после 492.2 ± 20.5 мс; p > 0.05) (рис. 4).
Скоростносиловые свойства. Уменьшение МПС (33.5 %) было связано с существенным замедлением скорости развития напряжения во время выполнения «взрывного» произвольного изометрического сокращения (рис. 5), что видно в уменьшении выпуклости кривой сила–время), и уменьшением максимальной dPпс/dt), когда измерение было выполнено в абсолютных величинах (до 0.79 ± 0,04 кг×мс-1 после 0.55 ± 0,06 кг×мс-1). Нормализованная (% МПС) величина dPпс/dt уменьшилась на 18,7 %.
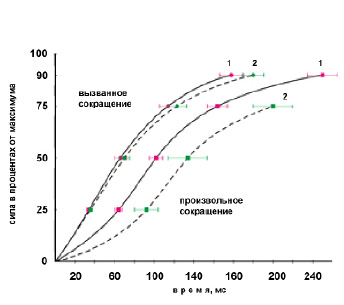
Рис. 5. Изменение усредненных кривых силавремя, выраженные в относительных величинах, при выполнении взрывного произвольного (вверху) и электрически вызванного (внизу) сокращений ТМГ (частота 150 имп/с) под влиянием 60-суточной АНОГ
Примечание. 1 – до; 2 – после воздействий.
Анализ электрически вызванных сокращений ТМГ не обнаружил существенных различий кривых сила–время (рис. 5) и максимальной dPтс/dt (до 0.76 ± 0,04 кг×мс-1 после 0.77 ± 0,05 кг×мс-1), тогда как максимальная нормализованная величина dPтс/dt увеличилась на 23,6 %.
Обсуждение. Основная цель настоящего исследования состояла в том, чтобы оценить влияние продолжительной (60суточной) АНОГ на сократительные свойства ТМГ в условиях in vivo у здоровых молодых мужчин. Полученные данные настоящего исследования показали, что сократительные свойства медленносокращающихся мышц-разгибателей стопы (напримере, ТМГ) [4] относительно быстро изменяются под воздействием механической разгрузки, дополняя, таким образом, ранее полученные наши данные [5, 30, 31].
Быстрая природа изменений характеристик кривой развития изометрической Рос (ВОС и 1/2 ПР), с одной стороны, может быть объяснена, относительно большей атрофией медленносокращающихся волокон (типа I), которые составляют большинство ТМГ [28], а с другой стороны, – длительностью переходных процессов Са2+ (освобождение и потребление) саркоплазматическим ретикулумом (СР) в результате механической разгрузки мышцы [16]. Первичным триггером этих изменений может быть изменение скорости выделения Са2+ из миофибриллярных белков [16]. Как было показано ранее, при неупотреблении мышцы отмечается снижение скорости потребления Са2+ [29]. Снижение скорости освобождения Са2+ отразится либо на увеличении времени кривой развития Рос, либо позволит развить большую величину Рос.
Природу снижения Рос трудно объяснить. Первичный фактор объяснений этих изменений может быть связан с изменениями в функции СР [16]. Однако это трудно представить, поскольку влияние СР на Рос может «маскироваться» атрофическими процессами, но тем не менее, это представляет интерес, т.к. предполагается, что изменение Рос происходит благодаря изменениям в СР. Изменения в кинетике механических ответов при парном раздражении с разными межимпульсными интервалами указывает именно на изменение кинетики развития Са2+ в мышце. Уменьшение длительности одиночного сокращения ТМГ может быть отчасти следствием снижения Рос.
Кроме того, изменение в показателях Рос может быть причиной изменений в чувствительности после механической разгрузки, как отмечалось ранее [26], и мышечной температуры. Мы предполагаем, что в нашем эксперименте постельный режим – причина уменьшения в чувствительности мышцы. Колебание температуры тела также может быть причиной изменения температуры мышцы и таким образом влиять на их сократительные свойства [20]. В настоящем исследовании у всех испытуемых непрерывно контролировалась температура тела, которая была в пределах физиологической нормы (в среднем 36.4¾36.6°C). Снижение температуры в пределах 5°C рассматривается как физиологическая норма. АНОГ не «сухая» водная иммерсия, когда действительно отмечается некоторое снижение температуры тела [1]. Однако величина уменьшения является настолько незначительной, что это не может быть связано с такой величиной как скоростью распространения нервного импульса по мышечному волокну [8] и соответственно в этом случае можно проигнорировать возможность влияния этого фактора.
Уменьшение Рос, наблюдаемой в настоящем исследовании, согласуется с предыдущими результатами, которые показали снижение мышечной силы во время произвольных и электрически вызванного сокращений [5, 30, 31]. У всех испытуемых после АНОГ обнаружено однонаправленное уменьшение Рос и Ро ТМГ. Ро ТМГ уменьшается, составляя 18 % ее исходной величины. Величина Ро является показателем способности мышцы генерировать максимальную силу и отражает число активных мостиков между актиновыми и миозиновыми нитями [18]. АНОГ продуцирует снижение Ро [5, 23, 24, 30, 31], что, вероятно, отражает снижение числа активных поперечно-полосатых мостов и как следствие – уменьшение работоспособности. По этому случаю можно высказать два предположения. Первое, после АНОГ общее количество поперечно-полосатых мостов было уменьшено, и второе, что сила, развиваемая каждым мостиком, была снижена. Однако, когда удельная сила мышцы рассчитывалась на единицу площади поперечного сечения, то сила оказывается была одинаковой после неупотребления [41]. Это указывает, что предположение об уменьшении максимального числа поперечных мостиков более адекватна к нашим результатам, чем изменение их плотности. Таким образом, снижение Ро ТМГ может быть непосредственно связано с уменьшением диаметра волокон и с атрофией мышцы.
Дополнительно, снижение Ро целой мышцы предполагает, что продолжительная механическая разгрузка может затронуть некоторые этапы связи возбуждение–сокращение [24]. Это может быть изменение в сарколемме потенциала действия, изменение движения заряда в T-тубулярных каналах и/или прямое влияние на потребление Са2+ СР. Альтернативно, неупотребление, вызывая атрофию мышцы, может увеличить внеклеточное пространство и напряженность мышцы, в целом, уменьшиться больше, чем площадь поперечного сечения волокна.
Механизмы, ответственные за потерю силы мышцы при неупотреблении, остаются не вполне ясными. Уменьшение площади поперечного сечения медленно и быстросокращающихся волокон мышцы не может быть одним из возможных механизмов, ответственных за снижение силы, хотя атрофия мышцы, вероятно, вносит вклад в потерю силы. Морфологические исследования в настоящем исследовании не были выполнены. Однако Hikida et al. [27] показали, что относительные изменения в размере мышцы и волокон были меньше, чем относительное изменение в силе. Эти авторы показали, что ультраструктурные изменения, возможно, уменьшили способность продуцировать силу сокращения мышцы во время и после продолжительной механической разгрузки.
Намного большее уменьшение МПС (34 %), по сравнению с незначительными изменениями в Ро (18 %) после 60-дневной АНОГ указывает на неспособность центральной нервной системы нормально активировать ТМГ. Является ли это недостатком мотивации со стороны отдельных испытуемых, или в непроизвольном уменьшении нервного драйва, трудно распознать. Хотя все испытуемые были крайне высоко мотивированы и не сообщали о возможном дискомфорте или жесткости в коленном суставе при выполнении тестовых испытаний (развитие МПС), которые могли бы объяснить низкий показатель МПС. Увеличение Рд свидетельствует о снижении центрального драйва в нервной системе, что снижает моторный контроль произвольного сокращения мышцы. Фактически, во время выполнения МПС электромиографическая активность была значительно измененной в результате механической разгрузки [24, 25]. Кроме того, снижение амплитуды после разгрузки предполагает, что меньшее число двигательных единиц мышцы было активировано при неупотреблении [25], и более того, было обнаружено уменьшение максимальной частоты импульсации двигательных единиц [23]. Уменьшение в максимальной частоте импульсации мотонейронов можно было бы объяснить изменениями в проприоцептивных афферентах [36].
Скорость развития вызванного сокращения в ответ на электрическую стимуляцию нерва (частота 150 имп/с) и рассчитанная в относительной шкале изменилась незначительно после АНОГ. Это наблюдение согласуется с ранее полученными данными, что при разгрузке мышц не отмечалось существенных изменений в скоростно-силовых характеристиках мышц, [44] и поддерживает наблюдения об относительном постоянстве механизма тетанического сокращения и современной (поперечных мостиков) теории мышечного сокращения [42]. Поэтому, по-видимому, разумно заключить, что неупотребление (например, АНОГ) имеет небольшое влияние на цикл поперечных мостиков или на активность миозина [19].
Таким образом, результаты настоящего исследования, во-первых, подтверждают ранее полученные наши данные, что неупотребление мышц ассоциируется, как с уменьшением сократительных способностей к мобилизации резервов самой мышцы (периферический фактор), так и снижением центральной (моторной) «посылки» [5, 6, 32]. Изменения в скоростных сократительных свойствах могут указывать на изменения кинетики развития активного состояния контрактильных элементов мышцы. Во-вторых, максимальные значения степени изменений функциональных свойств нервно-мышечного аппарата у человека достигают, по-видимому, на относительно раннем этапе воздейстия микрогравитации и глубина этих изменений постепенно дрейфует по мере увеличения срока пребывания в услових микрогравитации.
Автор выражает признательность всему обслуживающему персоналу и особая благодарность всем испытуемым, принявших участие в эксперименте, без которых невозможно было бы получить фактический материал.
Автор также выражает благодарность проф. И.Б. Козловской за поддержку научного направления при проведении данного исследования.

