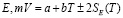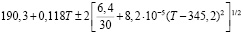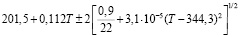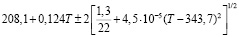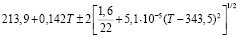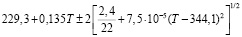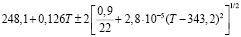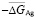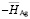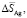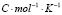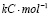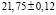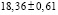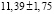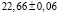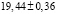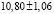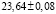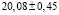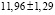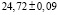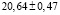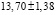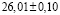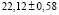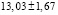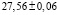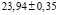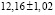Халькогерманаты и халькостаннаты серебра относятся к числу перспективных функциональных материалов, обладающих полупроводниковыми, фотоэлектрическими и термоэлектрическими свойствами [1, 4, 7]. Для поиска новых многокомпонентных халькогенидов серебра с германием и оловом целесообразно исследование фазовых равновесий в соответствующих системах. Особый интерес представляют системы, включающие соединения-аналоги, так как в них можно ожидать образование широких областей твердых растворов
В данной работе представлены результаты исследования системы Ag8GeS6-Ag8SnS6.
Исходные соединения изученной системы изучены подробно.
Ag8GeS6 плавится с открытым максимумом при 1218К и претерпевает полиморфное превращение 496К [1, 5]. Низкотемпературная модификация Ag8GeS6 кристаллизуется в ромбической решетке (Пр.гр. Pna21) с параметрами a=15.149, b=7.476, c=10.589 Å [6], а высокотемпературная имеет кубическую структуру (Пр.гр. F-43m) с периодом решетки а=10.70 Å [8].
Соединение Ag8SnS6 также плавится конгруэнтно при 1125К [9]. Температура полиморфного превращения равна 444К [9]. Обе модификации Ag8SnS6 изоструктурны с соответствующими кристаллическими модификациями Ag8GeS6 и имеют следующие параметры решетки: a=15.298, b=7.548, c=10.699 Å [10], а=10.85 Å [8].
Материалы и методы исследования
Исходные соединения синтезировали сплавлением элементарных компонентов с чистотой не менее 99,999 % в стехиометрических соотношениях в откачанных до ~10-2Па и запаянных кварцевых ампулах. Синтезы проводили в двухзонной наклонной печи. Нижнюю горячую зону нагревали до температуры на 30-500 выше точки плавления синтезируемого соединения, а холодную до 650К, что несколько ниже температуры кипения серы [2].
Индивидуальность синтезированных соединений контролировали методами ДТА и РФА. Синтезированные нами соединения имели следующие температуры полиморфных переходов и плавления: Ag8GeS6 (490; 1220K), Ag8SnS6 (445; 1120K), которые близки к вышеуказанным литературным данным.
Полученные порошковые рентгенограммы низкотемпературных модификаций соединений Ag8GeS6 и Ag8SnS6 были аналогичны с данными [6, 10]. В результате их расшифровки получены следующие параметры орторомбической решетки (Пр.гр. Pna21):
Ag8GeS6 a=15,1292; b=7,4565; c=10,5535 Å
Ag8SnS6 a=15,3338; b=7,5620; c=10,7244 Å
Сплавлением исходных соединений в различных соотношениях в вакуумированных кварцевых ампулах синтезировали сплавы системы Ag8GeS6-Ag8SnS6, которые для гомогенизации отжигались при 900К в течение 500 ч и охлаждались в режиме выключенной печи. Серия сплавов по разрезу Ag8GeS6-Ag8SnS6 после отжига закалялись вбрасыванием ампул в холодную воду.
Исследования проводили методами ДТА (пирометр НТР-70, прибор Термоскан-2) и РФА (порошковый дифрактометр D8 ADVANCE фирмы Bruker, CuK1), а также измерением ЭДС концентрационных цепей типа
(-) Ag (тв) / Ag4RbI5(тв) / (Ag в сплаве) (тв) (+) (1)
В цепях типа (1) электролитом служил твердый суперионный проводник Ag4RbI5, обладающий высокой ионной проводимостью уже при комнатной температуре [3]. Левым электродом служило металлическое серебро, а правыми электродами - равновесные сплавы системы Ag8GeS6-Ag8SnS6 с различными составами. ЭДС измеряли компенсационным методом с помощью цифрового вольтметра марки В7-34А в интервале температур 300÷390 К. Методики составления цепей типа (1) и измерений ЭДС описаны в [3].
Результаты исследования и их обсуждение
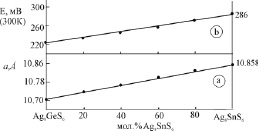
Результаты ДТА и измерений ЭДС равновесных сплавов системы Ag8GeS6-Ag8SnS6 приведены в табл. 1.
Таблица 1
Результаты ДТА и измерений ЭДС сплавов системы Ag8GeS6-Ag8SnS6
|
Состав, мол % Ag8SnS6 |
Термические эффекты, К |
Е, мВ (300К) |
|
0 (Ag8GeS6) |
495; 1220 |
225,7 |
|
10 |
490; 1214 |
- |
|
20 |
480; 1190-1205 |
235,1 |
|
40 |
470-480; 1170-1190 |
245,3 |
|
60 |
455-470; 1150-1170 |
256,5 |
|
80 |
450; 1135 |
269,8 |
|
90 |
447; 1125 |
- |
|
100 |
445; 1120 |
285,9 |
Квазибинарная система Ag8GeS6-Ag8SnS6 (табл. 1, рис. 1) характеризуется образованием непрерывных рядов твердых растворов между обеими модификациями исходных соединений. Кривые ликвидуса и солидуса не имеют точек экстремума. На кривых полиморфного превращения d′↔d также отсутствует точка экстремума.
Результаты РФА отожженных и медленно охлажденных сплавов показали, что их дифракционные картины качественно аналогичны дифрактограммам низкотемпературных модификаций исходных соединений (рис. 2). С изменением состава происходит непрерывное смещение линий отражения между исходными соединениями. РФА сплавов, закаленных после отжига при 900К, показал, что они также однофазны и имеют кубическую структуру.
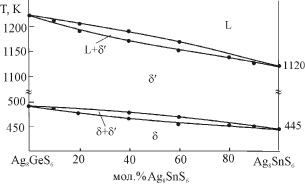
Рис. 1. Фазовая диаграмма системы Ag8GeS6-Ag8SnS6
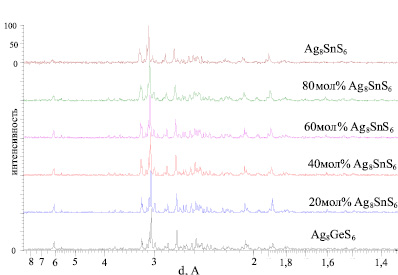
Рис. 2. Порошковые дифрактограммы некоторых сплавов системы Ag8GeS6-Ag8SnS6
В табл. 2 приведены параметры кристаллических решеток твердых растворов на основе обеих модификаций соединений, а на рис. 1,б - изменение периода кубической решетки высокотемпературных твердых растворов с составом, которое подчиняется правилу Вегарда.
Образование непрерывного ряда твердых растворов в системе Ag8GeS6-Ag8SnS6 между низкотемпературными модификациями подтверждено методом ЭДС (рис. 3,б). Значения ЭДС цепей типа (1) непрерывно меняются с изменением состава, что также свидетельствует об образовании непрерывного ряда твердых растворов между низкотемпературными модификациями исходных соединений.
Таблица 2
Типы и параметры кристаллических решеток сплавов системы Ag8GeS6-Ag8SnS6
|
Состав, мол % Ag8SnS6 |
Сингония, пространственная группа, параметры решетки, Å |
|||
|
Комнатная температура |
Закалка от 900К |
|||
|
орторомбическая, Pna21 |
кубическая, F-34m |
|||
|
a |
b |
c |
а |
|
|
0 (Ag8GeS6) |
15,1292 |
7,4565 |
10,5535 |
10,705 |
|
20 |
15,1777 |
7,4860 |
10,6071 |
10,736 |
|
40 |
15,2159 |
7,5052 |
10,6346 |
10,764 |
|
60 |
15,2299 |
7,5133 |
10,6440 |
10,797 |
|
80 |
15,2718 |
7,5296 |
10,6790 |
10,826 |
|
100 |
15,3338 |
7,5620 |
10,7244 |
10,858 |
Для проведения термодинамических расчетов результаты измерений ЭДС были обработаны в приближении их линейной температурной зависимости методом наименьших квадратов и представлены (табл. 3) в виде уравнений типа [3]:
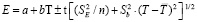
где n – число пар значений Е и Т; 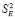 и
и 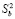 – дисперсии отдельных измерений ЭДС и постоянной b;
– дисперсии отдельных измерений ЭДС и постоянной b; 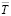 – средняя температура; t-критерий Стюдента. При доверительном интервале 95 % и n≥20 критерий Стюдента t≤2 [3].
– средняя температура; t-критерий Стюдента. При доверительном интервале 95 % и n≥20 критерий Стюдента t≤2 [3].
Таблица 3
Температурные зависимости ЭДС цепей типа (1) для сплавов системы Ag8GeS6-Ag8SnS6 (Т=300-390К)
|
Фаза |
|
|
Ag8GeS6 |
|
|
Ag8Ge0,8Sn0,2S6 |
|
|
Ag8Ge0,6Sn0,4S6 |
|
|
Ag8Ge0,4Sn0,6S6 |
|
|
Ag8Ge0,2Sn0,8S6 |
|
|
Ag8SnS6 |
|
Из данных табл. 3 по соотношениям
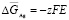 ; (3)
; (3)
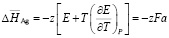 ; (4)
; (4)
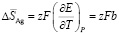 (5)
(5)
рассчитали парциальные молярные термодинамические функции серебра (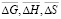 ) в сплавах при 298 К (табл. 4).
) в сплавах при 298 К (табл. 4).
Таблица 4
Ag8GeS6-Ag8SnS6 системиндя эцмцшцн 298К-дя парсиал молйар функсийалары
|
Фаза |
|
|
|
|
|
|||
|
Ag8GeS6 |
|
|
|
|
Ag8Ge0,8Sn0,2S6 |
|
|
|
|
Ag8Ge0,6Sn0,4S6 |
|
|
|
|
Ag8Ge0,4Sn0,6S6 |
|
|
|
|
Ag8Ge0,2Sn0,8S6 |
|
|
|
|
Ag8SnS6 |
|
|
|
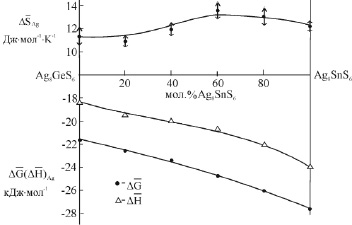
Кривые концентрационных зависимостей этих функций представлены на рис.4. Как видно, парциальные свободная энергия Гиббса и энтальпия серебра в сплавах являются монотонной функцией состава, что характерно для систем с непрерывными твердыми растворами замещения. Парциальная энтропия имеет несколько большую погрешность (вертикальные стрелки на рис. 4), поэтому трудно точно определить характер концентрационной зависимости этой функции. Однако ее непрерывное изменение с составом не вызывает сомнения. Таким образом, характер концентрационных зависимостей парциальных молярных функций серебра подтверждает отсутствие структурных превращений в твердых растворах Ag8GeS6-Ag8SnS6 при комнатной температуре.
Заключение
Квазитройная система Ag8GeS6-Ag8SnS6 характеризуется образованием непрерывных рядов твердых растворов как между высокотемпературными кубическими, так и межу низкотемпературными орторомбическими модификациями соединений Ag8GeS6 и Ag8SnS6. Парциальные термодинамические функции серебра в сплавах Ag8GeS6-Ag8SnS6, вычисленные из данных измерений ЭДС подтверждают образование непрерывных твердых растворов при комнатной температуре.