Синдром диспепсии в соответствии с рекомендациями согласительного совещания Международной рабочей группы по совершенствованию диагностических критериев функциональных заболеваний ЖКТ («Римские критерии III», 2006), определяется в настоящее время как ощущение боли или дискомфорта (тяжесть, переполнение, раннее насыщение), локализованное в подложечной области ближе к срединной лини. Накоплен достаточный потенциал научно-практических исследований, в том числе по диагностике и лечению синдрома диспепсии [3, 12]. Однако факторы риска развития функциональной диспепсии в настоящее время продолжают обсуждаться, существуют несколько противоречивые оценки роли отдельных этиологических и патогенетических факторов [5, 6, 13]. Применяющиеся методы лечения как органической, так и функциональной диспепсии не всегда высокоэффективны, что обусловлено, по-видимому, в том числе неоднородностью группы больных с синдромом диспепсии в клиническом и патогенетическом отношении. Невозможно не учитывать тот факт, что в мире растет количество людей с избыточной массы тела и алиментарным ожирением [1, 7], что обусловлено нарушениями структуры питания и гиподинамией [1, 8]. С учетом вышеизложенного, проведение исследований по изучению состояния адаптационных систем больных с синдромом диспепсии и в сочетании с ожирением представляется актуальным.
Цель исследования: повышение эффективности комплекса диагностических и лечебно-профилактических мероприятий у больных с синдромом диспепсии и ожирением на основе изучения особенностей циркадианного ритма секреции мелатонина, ритма приема пищи, артериального давления и вариабельности сердечного ритма.
Материалы и методы исследования
Под нашим наблюдением находились 70 больных (44 женщины и 26 мужчин) в возрасте от 20 до 60 лет (средний возраст 46,8±4,5 года) с синдромом диспепсии (38 – с функциональной диспепсией, 32 – с органической), а также 20 практически здоровых пациентов (1-я, контрольная, группа). Больные были разделены на 2 группы: 2-ю группу составили 28 пациентов с синдромом диспепсии и нормальным индексом массы тела – ИМТ, 3-ю – 42 пациентов с синдромом диспепсии и алиментарным ожирением.
Помимо стандартного обследования, необходимого для диагностики синдрома диспепсии (функциональной или органической), всем больным проводилось исследование циркадианной секреции мелатонина 4 раза в сутки стандартной методикой иммуноферментного анализа реактивами фирмы Buhlman n по определению melatonin sulfat 6 – sulfatoxymelatonin в моче, Для оценки циркадианных ритмов артериального давления (АД) и вегетативного баланса применялось суточное мониторирование АД (СМАД), вариабельности сердечного ритма (ВСР) и электрокардиография (ЭКГ) с помощью прибора «Cardio-Tens-01» («Meditech», Венгрия) с дальнейшим анализом результатов программой «Мedibase». В работе применялись клинико-психопатологический и экспериментально-психологический методы исследования, проведено обследование с использованием анкетирования: психологическим опросникам, опроснику качества сна и шкале сонливости Эпверта [2], анкете качества режима и суточного ритма питания [9].
Все исследования проводились в соответствии с принципами «Надлежащей клинической практики» (Good Clinical Practice). Участники исследования были ознакомлены с целями и основными положениями исследования и подписали информированное согласие на участие. Локальный этический комитет одобрил протокол исследования. Полученные данные обрабатывали статистически с помощью программ «Microsoft Excel» 5.0 и «Statistica» 6.0 for Windows c применением пара- и непараметрических критериев. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали p=0,05.
Результаты исследования и их обсуждение
Диагноз ставился на основании проведенного стандартного обследования, стандартов диагностики и Римских критериев III (2006 г.). Анализ полученных данных выявил достоверное снижение общей суточной секреции мелатонина при сравнении с 1-й контрольной группой во 2-й группе (120,5±13,4 пг/мл и 44,2±5,2 пг/мл, соответственно), наиболее выраженное в 3-й группе (24,1±6,3 пг/мл). Нарушения циркадианного ритма отмечались у всех обследованных пациентов с синдромом диспепсии: значительное (в 3,5 раза) снижение ночной секреции у 50 % больных, умеренное (в 2,1 раза) у 23 % пациентов (при сравнении с контрольной группой), что коррелировало (r=0,68, (p<0,05)) со степенью выраженности болевого синдрома. Во 2-й группе в 75 % случаев ночной пик секреции мелатонина отсутствовал.
Анализ результатов суточного мониторирования артериального давления выявил признаки артериальной гипертензии во 2-й группе у 66,6 % пациентов, в 3-й – у 92 %, преимущественно систолического характера (среднесуточный уровень систолического АД составил более 135 мм рт.ст., индекс нагрузки давлением составил более 50 %). Распределение больных по суточному профилю АД: dippers – 44,2 %, over-dippers –18,8 %, non-dippers – 31,2 %, night-peakers – 5,8 % (рис. 1). У 1/3 пациентов достаточного снижения уровня АД в ночные часы не регистрировалось.
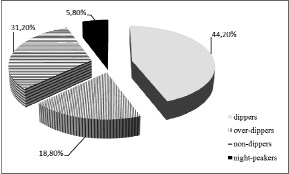
Рис. 1. Результаты суточного мониторирования артериального давления
При анализе результатов суточного мониторирования ЭКГ и анализа интервалов RR оценивали временные и спектральные показатели ВСР. По данным спектрального анализа достоверные отличия (р=0,05) от 1-й группы имелись у больных 3-й группы – по большинству показателей спектрального анализа – суточным, дневным и ночным (рис. 2), при этом наибольшие отличия зафиксированы в ночное время суток. Кроме этого, в 3-й группе циркадианная ритм (день/ночь) вариабельности сердечного ритма практически отсутствовал.

Рис. 2. Результаты суточного мониторирования вариабельности сердечного ритма (по показателю спектрального анализа LF/HF)
В результате анализа оценки режима питания выявлены нарушения суточного ритма приема пищи у 24 (86 %) больных 2-й группы, 36 (90 %) больных 3-й группы и лишь у 10 (50 %) пациентов 1-й, контрольной, группы (согласно результатам анкетирования) (Рис. 3). У пациентов с синдромом диспепсии и ожирением преобладал следующий ритм приема пищи: кратность приема пищи в сутки – 2-3 раза; время последнего за сутки приема пищи – ближе к 21 ч; распределение суточной калорийности в течение суток – основной прием во второй половине дня; ночной прием пищи – 3-4 раза в неделю; нерегулярный прием пищи (не в одно и то же время в течение суток) – более 4 раз в неделю.
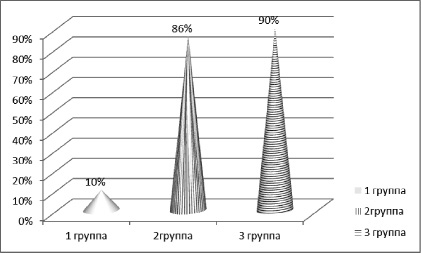
Рис. 3. Результаты оценки нарушений суточного ритма приема пищи
Нарушения сна выявлены у 18 (55 %) пациентов с органической диспепсией и у 24 (81 %) больных с функциональной диспепсией, из них 92 % и 96 % больных (соответственно) имели коморбидное ожирение. У 42 % пациентов 3-й группы были выявлены проявления синдрома ночного переедания: жалобы на нарушения ночного сна, повышение аппетита во второй половине дня, приемы пищи после ужина и ночью, отсутствие аппетита утром. Из них у 27 % его проявления носили особенно тяжелый характер: страх наступления вечера в связи с невозможностью контролировать приступы голода, чувство вины за переедание, ощущения беспомощности, приступы тошноты по утрам, потребление более 50 % суточного объема пищи после ужина. У 13 % установлены феномены приступов переедания, случающиеся не реже 1-2 раз в неделю на протяжении полугода. Прием пищи у таких пациентов не связан с чувством голода, сопровождается потерей контроля над количеством съедаемого, а также снижением интенсивности вкусовых ощущений. У 22 % пациентов переедание было стойко связано с развитием стрессовой ситуации и прекращалось по мере разрешения конфликта. Приемы пищи не носили характер приступов, ко времени суток не были привязаны, ощущение удовлетворенности и снижения тревоги отмечали пациенты после приема пищи, а при выходе из стресса пытались самостоятельно похудеть.
При проведении корреляционного анализа между отдельными изучаемыми показатели пациентов исследуемых групп выявлены прямые и обратные достоверные (p<0,05) корреляционные связи средней и высокой степени выраженности: между показателями секреции мелатонина, отдельными характеристиками ВСР, нарушений сна и суточного ритма питания.
Заключение
Полученные данные свидетельствуют о наличии нарушений циркадианного ритма секреции мелатонина, ВСР и АД, дисбаланса вегетативной нервной системы с преобладанием симпатических влияний и их тесной взаимосвязи с другими показателями у больных синдромом диспепсии, особенно имеющим в качестве коморбидной патологии ожирение. Результаты исследования позволяют предположить, что нарушения циркадианного ритма секреции мелатонина, вегетативного баланса и артериального давления могут играть определенную роль в формировании синдрома диспепсии с ожирением, диктуют необходимость дальнейших исследований, их следует учитывать при разработке лечебно-диагностических мероприятий. Перспективными в плане эффективной коррекции выявленных нарушений представляются в том числе подходы с применением инновационных технологий [4, 10, 11], физиотерапевтических, психотерапевтических и других методик.

