Введение
В последние 15-20 лет в развитых странах интенсивно внедряется направление лечения онкологических заболеваний с использованием меченых антител –радиоиммунотерапия (далее-РИТ). В клинической практике в развитых странах с успехом используются несколько типов радиофармпрепаратов (далее РФП) на основе противоопухолевых моноклональных антител ( алее-монАТ)[8,11].Терапевтическа эффективность этого нового класса РФП во многих случаях очень высока и обусловлена целенаправленной доставкой источника ионизирующего излучения(радионуклида) в опухоль антителами, взаимодействующими с мишеневыми антигенами на клетках опухоли.Помимо этого, сами антитела могут обладать цитотокси-ческим действием на опухолевые клетки. Сейчас уже широко используется в научной литературе термин “таргетная терапия” для обозначения особого типа лечебного действия препаратов, созданных на основе антител, их фрагментов, пептидов[8,10,11]. Тем самым подчеркивается целенаправленный, ”адресный” транспорт и взаимодействие введенного( внутривенно или эндо-лимфатически) во внутреннюю среду препарата с мишеневыми антигенами на клетках.
Важным аспектом лечебной эффективности РФП является количество связанного с носителем радиоактивности, обеспечивающее радиотоксический эффект на клетки в патологическом очаге [9,11,12]. МонАТ чрезвычайно избирательны как транспортеры для доставки в опухоль радионуклида. Задача разработчиков радиотерапевтических комплексов на основе монАТ состоит в том, чтобы создать необходимую для достижения лечебного эффекта удельную радиоактивность РФП.
В этом плане хорошим объектом служит давно используемый в клинической и экспериментальной медицине 131I, обладающий приемлемыми параметрами как для диагностических, так и лечебных целей ( гамма-излучатель с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ) -и бета-излучатель (β-частицы с максимальной энергией 0,807 МэВ) со сравнительно коротким временем полураспада- 8, 02 сут.).Для его связывания с молекулами антител( иммуноглобулинов) традиционно используется хлорамин-Т (натриевая соль N-хлор-р-толуолсульфонамина). Получаемые комплексы монАТ с 131I(131I-монАТ) обладают удовлетворительными характеристиками для радиоиммунодиагностики [1-6,9]. Однако, необходимость включения в молекулу иммуноглобулина( антитела) высокой дозы радиоактивности для целей радиоиммунотерапии не позволяет с успехом использовать хлорамин-Т, поскольку это приводит к значительной потере иммунореактивности монАТ после процедуры мечения.
В связи с этим, в работе проведено исследование эффективности связывания 131I с монАТ и степень сохранения их иммунореактивности после процедуры радиомечения с использованием препарата “Iodogen”, зарекомендовавшим себя как активный окислитель.
Материалы и методы
Процедура радиомечения монАТ. Моноклональные антитела серии ИКО-1 направлены против Ia-антигенов, экспрессируемых на клетках эритро- и В-лимфолейкозов .Их титр в тесте иммунофлуоресценции составлял 1:100.Лиофилизи-рованные с бычьим сывороточным альбумином монАТ растворяли в фосфатном буфере( рН 7,4) до концентрации 10мг/мл. К 2 мл раствора Na131I в фосфатном буфере( 37 Мбк/мл) добавляли 2 мл раствора монАТ( 1 мг/мл) и вносили в смесь 500 мкг реактива “Iodogen”( 1,3,4,6-тетрахлор-3-альфа,6-альфа-дифенилгликоурил)(Pierce,Beijerland , Нидерланды).
В варианте сравнения, к смеси 131I с монАТ добавляли 200 мкг реактива “ хлорамин-Т” (натриевая соль N-хлор-р-толуолсульфонамина). В обоих вариантах реакции продолжа-лись 5 мин, после чего блокировались добавлением в смеси 100 мкг аскорбиновой кислоты.
Отделение фракции меченых антител от примесей. Для разделения меченных 131I- монАТ и радиоактивных примесей раствор элюировали методом жидкостной хроматографии на колонках с носителем Sephadex G-15(Pharmacia,Швеция); элюэнтом был фосфатный буфер. Спектр элюируемых фракций монАТ и примесей с радиоактивной меткой определяли на анализаторе “Honeywell”( Великобритания).Помимо этого, анализ чистоты фракции меченных антител проводили методом тонкослойной хроматографии на пластинах с носителем Silufol UV-254.
Тесты для определения иммунной реактивности антител. Иммунологическую реактивность монАТ до и после процедуры связывания с радионуклидом исследовали в цитотоксическом тесте ин витро в присутствии комплемента морской свинки. Клетками-мишенями в тесте служили лимфоциты лимфатических узлов мышей а также клетки опухолевых линий мышиного лимфолейкоза L1210 и гемоцитобластоза La, экспресси-рующие мишеневый антиген Ia. Цитотоксичность монАТ определяли по интенсивности выхода красителя “трипанового синего”(Gibco, Шотландия).Опухолевые линии мышиных лейкозов получены из лаборатории экспериментально-биологических моделей РОНЦ РАМН. Суспензии клеток доводили до концентрации 108/мл, вносили в 96-луночные планшеты для культивирования клеток( Costar,США) и добавляли в лунки антитела, меченные 131I по методу “Iodogen” или методом “ хлорамин-Т “. В качестве контроля в лунки планшет вносили неиммунные иммуноглобулины( IgG-класса).
После 30 мин культивирования в CO2-инкубаторе в лунки добавляли краситель “трипановый синий”, через 10 мин клетки отделяли от надосадочной жидкости центрифугированием(1500 об/мин) и определяли интенсивность окрашивания раствора на спектрофотометре, тем самым оценивая жизнеспособность клеток-мишеней по выходу из них красителя.
Исследование биораспределения радиомеченных монАТ в органах животных. В опытах использовали мышей гибридной линии BDF1( DBA/2 x C57Bl/6)F1 в возрасте 3 мес, массой около 20 г. За 6 сут до проведения опытов животным вводили внутрибрюшинно по 5.106 клеток лимфолейкоза L1210. Для исследований отбирали мышей с солидными формами лейкоза, локализованными на брыжейке кишечника. В день исследования, животным проводили блокаду щитовидной железы питьевым раствором 1,5% иодистого калия. После этого им вводили внутривенно по 0,2 мл раствора меченных монАТ с удельной активностью 1 МБк/ мл.В качестве контроля другой группе животных вводили внутривенно 0,2 мл неиммунных мышиных иммуноглобулинов IgG класса, меченных 125I.
Через 24 ч мышей забивали, выделенные органы подвергали радиометрии в дифференциальном режиме для 125 I и I 131 в колодезном счетчике. Для определения введенной дозы радиоактивности использовали 0,2 мл раствора меченных антител.
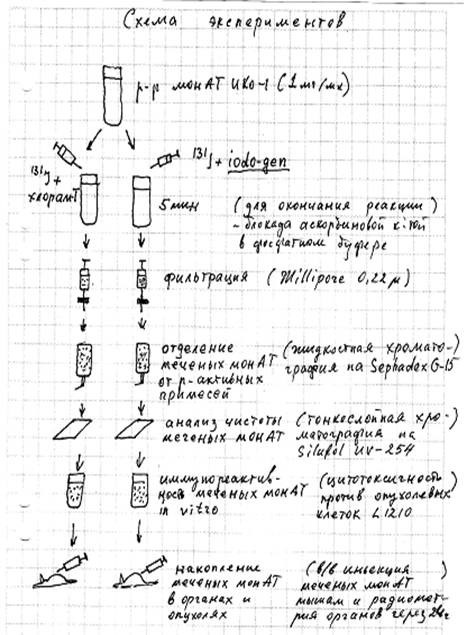
Результаты
После процедуры связывания радионуклида с молекулами иммуноглобулинов было проведено отделение( выделение) фракции связавшихся с радиоактивной меткой антител от различных видов примесей и свободного радионуклида. Использовали метод жидкостной хроматографии с подключением счетчика-радиометра для определения уровней радиоактивности различных элюированных фракций. Результаты этого исследования приведены на рис.1. Они свидетельствуют о том, что основная часть радионуклида связалась с иммуноглобулиновой фракцией( антителами). При этом, в случае использования агента “Iodogen” эффективность связывания составила 86,5 %, тогда как при использовании агента” хлорамин-Т” она была около 43%.Лишь малая доля радиоактивности приходилась на примесные фракции( около 13%).
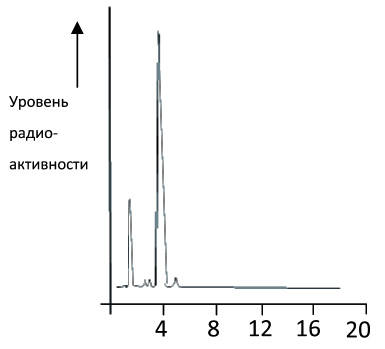
Рис.1.Качественный анализ фракции РФП 131-I ИКО-1 (жидкостная хромато-графия) после процедуры мечения с реагентом “Iodogen”
(Пик 1 – радиоактивные примеси(13%; 1,5 мин); пик 2 – 131I -ИКО-1,( 86,5%, 5 мин)
Анализ чистоты фракций меченных антител был подтвержден и методом тонкослойной хроматографии.
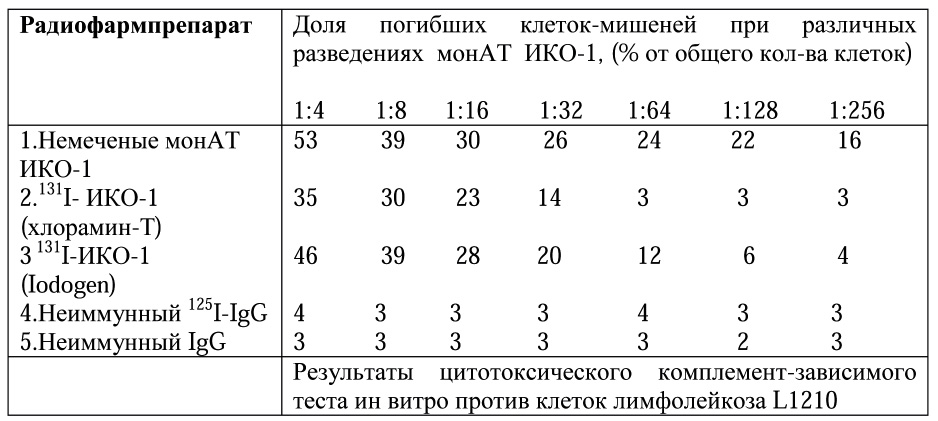
Следующим этапом нашей работы был анализ иммунологической реактивности противоопухолевых антител после проведения процедуры радиомечения. Для этого были исследованы иммунологические свойства антител ИКО-! в тесте комплемент-зависимой клеточной цитотоксичности против различных клеток-мишеней, в том числе и против опухолевых клеток, экспрессирующих в повышенной концентрации Ia-антигены. И снова, тесты были проведены в сравнительном аспекте для антител, меченных по методу “ Iodogen” или методу ”хлорамин-Т”. Результаты проведенных исследований представлены в табл.1.
Они свидетельствуют о том, что после проведения процедуры радиомечения антитела теряют некоторую долю иммунологической реактивности. При малых разведениях сыворотки( от 1:4 до 1:32) снижение реактивности составляет 20-25%, тогда как при больших разведениях она более выражена( до 75-80 %). По-прежнему, результаты теста более удовлетворительные для реагента”Iodogen” в сравнение с методом”хлорамин-Т”.
Таблица 1
Иммунологическая реактивность монАТ ИКО-1 после связывания с радионуклидом 131I
Следующим этапом было исследование специфичности накопления меченных радионуклидом противоопухолевых антител в органах и тканях лабораторных животных с опухолями в экспериментах ин виво. Схема проведения этой части экспериментов представлена в разделе“Материалы и методы”.Результаты проведенной работы представлены на рис.2.Обращает на себя внимание высокое накопление радиофармпрепарата в ткани опухоли в сравнении с любым из исследованных органов. При этом, избирательно накапливались антитела в опухолевом очаге ,меченные как по методу”Iodogen”, так и по методу” хлорамин-Т”.Но и здесь, результаты биораспределения радиофармпрепаратов, приготовленных по методу”Iodogen”, были предпочтительные в сравнении с препаратами метода “хлорамин-Т”.
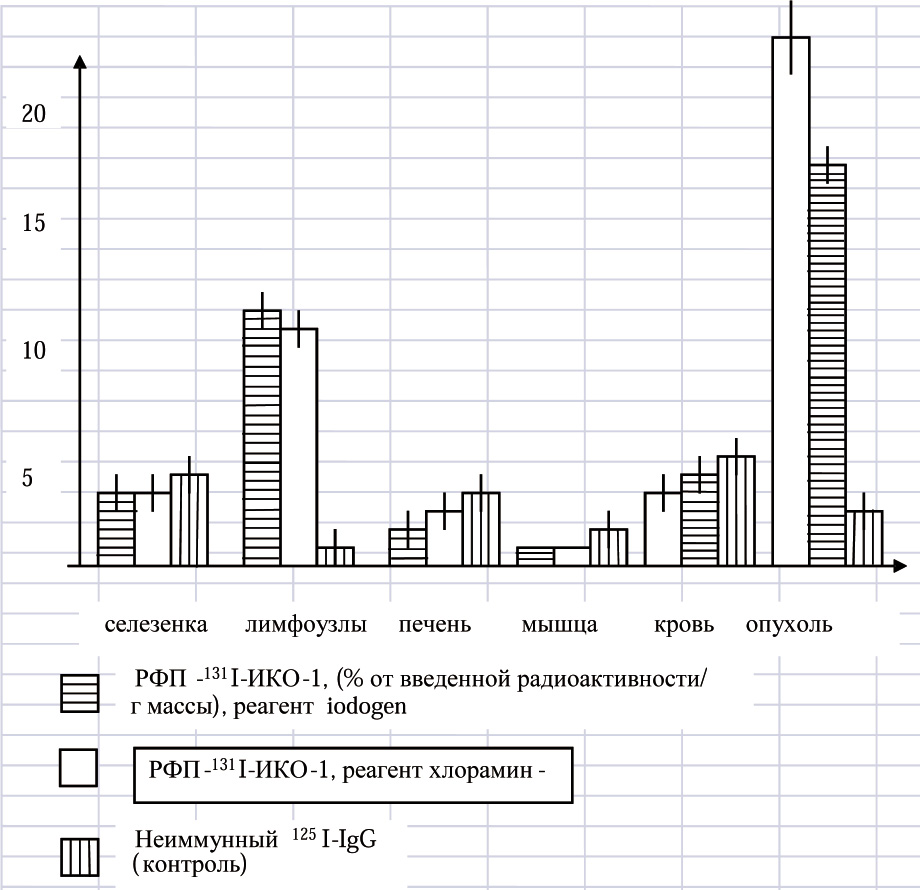
Рис.2. Накопление меченных радионуклидами моноклональных антител в органах мышей с опухолью. В каждой экспериментальной группе использованы не менее 3 животных(n=3). Данные представлены в виде средних величин и средне - квадратичных отклонений от них ( М_+ m)
Ранее проведенные нами исследования по направленному транспорту радиофармпрепаратов на основе моноклональных противоопухолевых антител в опухолевый очаг показали весьма удовлетворительные результаты.[1-5].Однако, довольно высокая доля накопления препарата в крови и в печени заставила искать более эффективные методы связывания радионуклида с антителами с сохранением возможно большей иммунореактивности после радиомечения [7].. Тем самым было возможно снизить неспецифический компонент связывания антител в не-мишеневых органах. Эти поиски привели нас к реагенту “Iodogen”, который оказался не только более активным окислителем, но и позволял сохранить достаточно высокий уровень иммунореактивности антител после коньюгации с радионуклидом[8,12].. Результаты экспериментов показали снижение неспецифического компонента накопления радиофармпрепарата в таких органах, хотя различия при использовании обоих методов связывания антител с радионуклидом недостоверны.
Выводы
1) С помощью препарата Iodogen возможно более эффективное связывание радионуклида 131I с монАТ, чем при использовании окислителя хлорамина-Т.
2) Иммунологические свойства коньюгата на основе монАТ изменяются после процедуры радиомечения примерно одинаково для обоих окислителей .Такие характеристики являются важными при создании РФП с высокой удельной радиоактивностью для радионуклидной диагностики и радиоиммунотерапии онкологических заболеваний.
3) Использование агента “Iodogen” позволило создать комплекс моноклональных антител с радионуклидом 131I с лучшими характеристиками направленного транспорта в опухолевый очаг в сравнении с аналогичным комплексом, полученным по методу “хлорамин-Т”.

