Введение
С самого начала применения ультраструктурного анализа для изучения патологии миокарда было обнаружено, что первыми на любое воздействие реагируют митохондрии. В дальнейшем была установлена их причастность к процессу старении и гибели клеток [2,3,9 ].Показано, что митохондрии, являясь продуцентом активных форм кислорода (АФК), запускают в клетке окислительный стресс, приводящий к серьезной патологии клеток, их гибели и нарушению функционирования всего органа [8,10 ]. В последние годы накоплены данные о том, что состояние митохондрий зависит от соотношения белков слипания и деления (fusion and fission) [7 ]. Ранее нами было показано, что при патологии сердца происходит накопление в кардиомиоцитах (КМЦ) огромного количества поврежденных митохондрий, что приводит к энергетической несостоятельности КМЦ, невозможности осуществления сократительной функции, старению и гибели клеток[2,3 ].
Целью настоящего исследования было проанализировать состояние митохондриального аппарата при различных заболеваниях сердца и в эксперименте, сопоставить полученные ультраструктурные данные с тяжестью клинических проявлений.
Методика исследования
Были изучены эндомиокардиальные биопсии от больных с различными сердечными заболеваниями: ишемической, дилатационной, диабетической, алкогольной кардиомиопатиями, аритмогенной дисплазией правого желудочка, пароксизмальными тахиаритмиями. Биоптаты эндомиокарда были получены с диагностической целью при проведении вентрикулографии из правого или левого желудочков и межжелудочковой перегородки; при нарушениях ритма сердца биоптаты забирались интраоперационно из правого желудочка, межелудочковой перегородки и правого предсердия. Кроме того был изучен миокард левого желудочка крыс линии Вистар при экспериментальной адриамициновой и алкогольной кардиомиопатиях [4,6 ]. Ткань миокарда фиксировали в забуференном растворе параформальдегида, постфиксировали в четырехокиси осмия, после дегидратации заливали в Аралдит. Ультратонкие срезы готовили на ультрамикротомах фирмы LKB и Reichert, после двойного контрастирования уранилацетатом и цитратом свинца просматривали в электронных микроскопах JEM 100-cx и Philips SM-100.
Результаты исследования и их обсуждение
В миокарде желудочков больных кардиомиопатиями менялось типичное расположение органелл: межмиофибриллярная и субсарколеммальная популяции митохондрий практически отсутствовали. Митохондрии, в основном, базировались в околоядерной зоне, при тяжелых клинических состояниях, сопровождающихся сердечной недостаточностью, буквально становились преобладающей структурой в КМЦ, как бы вытесняя миофибриллы. Митохондрии были очень мелкими, их матрикс был электронно прозрачен, некоторые не содержали крист и выглядели как вакуоли. (Рис.1а). Несмотря на плотное прилежание митохондрий друг к другу, межмитохондриальные контакты не определялись. Встречались септированные митохондрии, митохондрии с перетяжками, с дополнительным компартментом (Рис.1а,б). В КМЦ можно было наблюдать резко измененные митохондрии, содержащие внутри мелкие «новорожденные» митохондрии, а также вакуоли, наполненные остатками митохондрий и другим биологическим «мусором»(Рис.1 в,г).
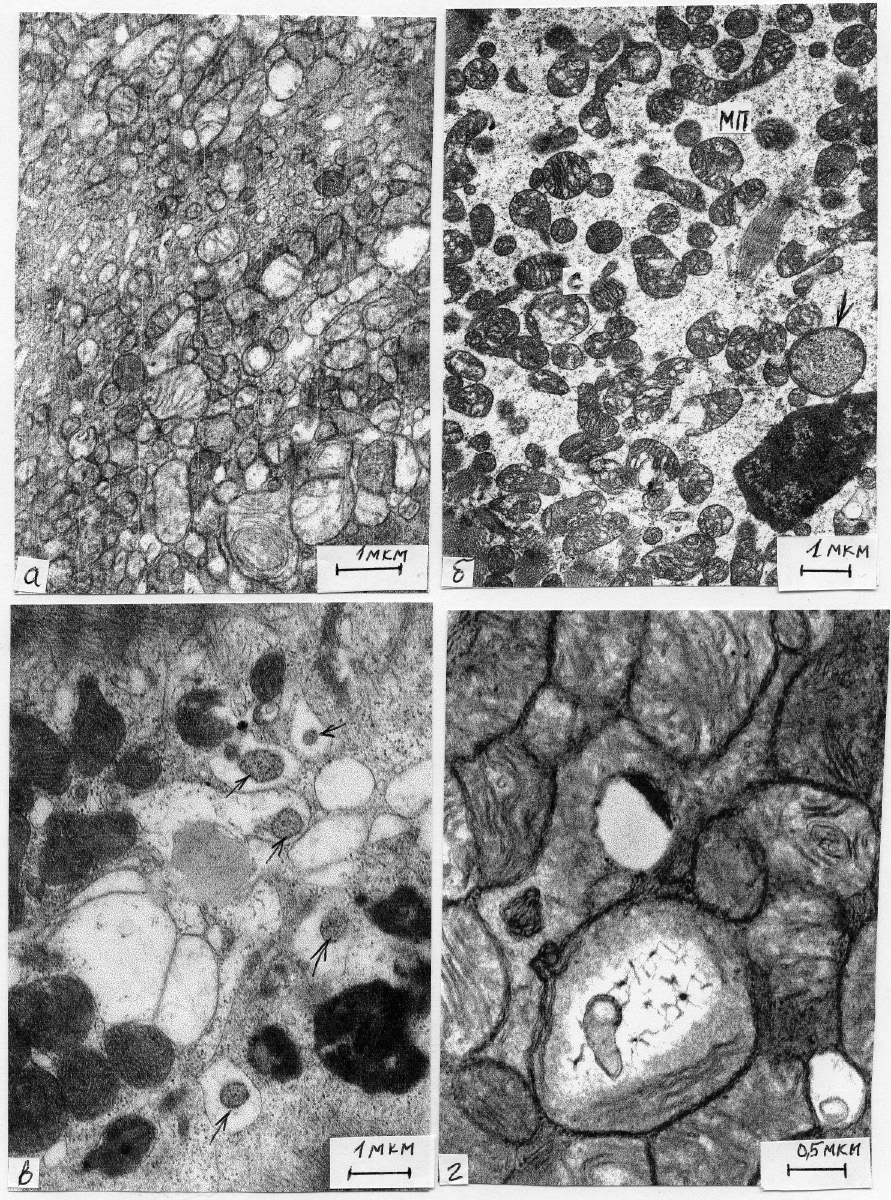
Рис.1.Ультраструктура митохондрий при различных заболеваниях сердца. (Увеличения показаны с помощью отрезков) 1а. КМЦ больного ишемической кардиомиопатией. Накопление мелких просветленных митохондрий в околоядерной зоне, некоторые практически лишены крист, 1б. Диабетическая кардиомиопатия. В КМЦ обнаруживаются септированные митохондрии(С), митохондрии с перетяжками (МП), а также с дополнительным компартментом (стрелка), 1в. Дилатационная кардиомиопатия. Внутри митохондрий, не содержащих крист, содержатся мелкие митохондрии(стрелки), 1г. Митохондрии с остатками крист и другим биологическим «мусором» в КМЦ при аритмогенной дисплазии правого желудочка
При пароксизмальных тахиаритмиях митохондрии в большинстве КМЦ были беспорядочно разбросаны по КМЦ, имели маленькие размеры, плотный матрикс. Такие КМЦ часто были соединены вставочными дисками с КМЦ в состоянии апоптоза.
При всех изученных патологиях и в эксперименте обращало на себя внимание взаимоотношений митохондрий и ядра. Можно было наблюдать тесное прилежание наружных мембран митохондрий и ядра, а также появление митохондрий в кариоплазме, причем число митохондрий варьировало от нескольких органелл до почти полного заполнения ядра (Рис.2а,б,в ) Внутриядерные митохондрии обнаруживались также в эксперименте при адриамициновой и алкогольной кардиомиопатиях(Рис.2в,г).
Явления микромитохондриоза, трансформации митохондрий в мелкие «бусинки» на нити были описаны ранее при различных патологических состояниях миокарда и в эксперименте [ 8]. Такая трансформация митохондрий была охарактеризована как митоптоз, гибель митохондрий, предшествовавшая апоптозу. В цитируемой работе проникновение трансформированных митохондрий в ядро объяснялось как перенос апоптотических белков измененными митохондриями в генетический аппарат ядра для запуска программы смерти [8] .В настоящем исследовании мы не обнаружили внутри ядра митохондрий с измененной ультраструктурой, внутриядерные митохондрии практически всегда отличались интактной структурой (Рис.2).
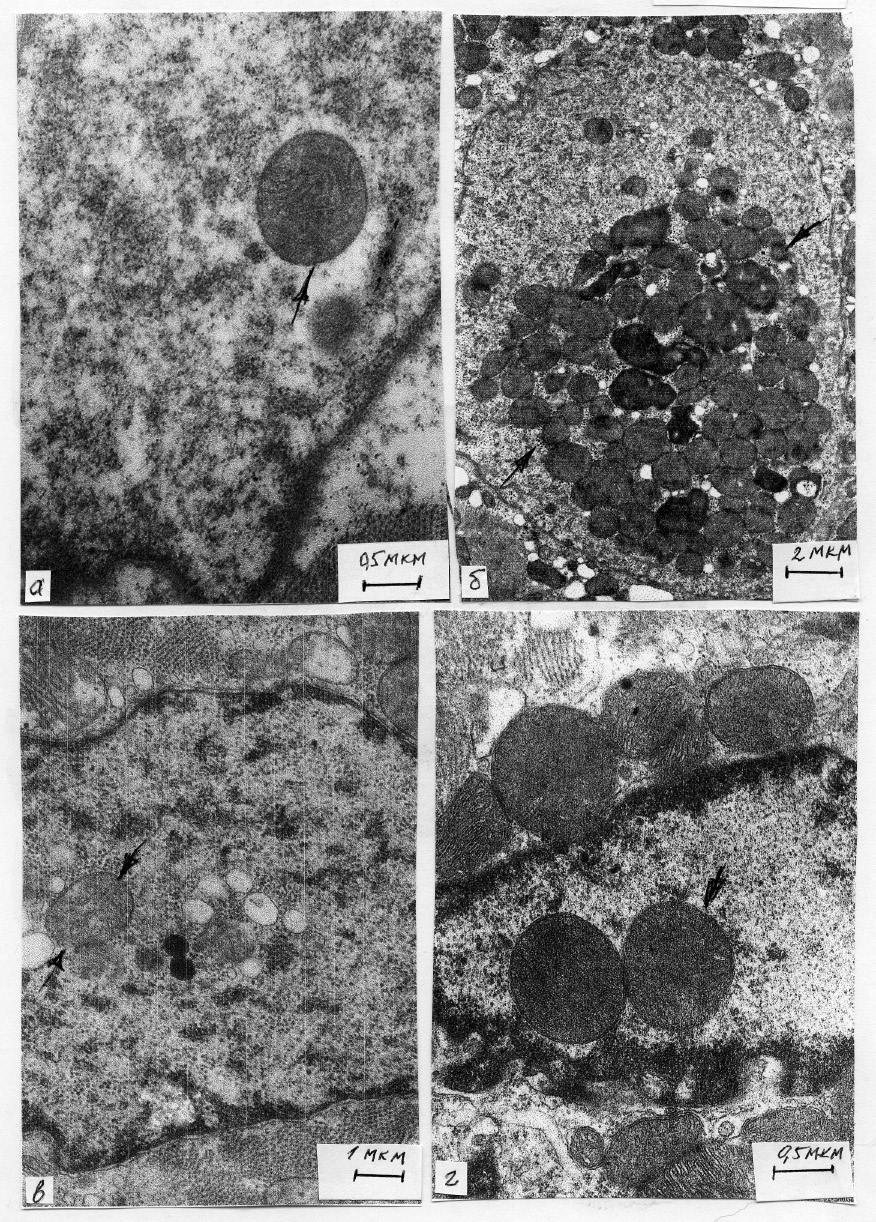
Рис.2.Взаимотношения митохондрий и ядра при различных заболеваниях сердца у пациентов и при экспериментальных кардиомиопатиях. (Увеличения указаны в виде отрезков). 2а. Единичная митохондрия в ядре КМЦ при ишемической кардиомиопатии (стрелка), 2б. Внутриядерное скопление митохондрий и липофусцина в КМЦ при дилатационной кардиомиопатии (стрелки), 2в. Появление митохондрий в ядре КМЦ при экспериментальной адриамициновой кардиомиопатии (стрелки), 2г. Митохондрии в ядре КМЦ при экспериментальной алкогольной кардиомиопатии (стрелка)
Известно, что митохондрии имеют собственный геном, который включает 37 генов, митохондриальная ДНК обеспечивает синтез 6-7% митохондриальных белков [ 1]. Репликация митохондрий контролируется ядерной ДНК, что отчасти объясняет тесный контакт митохондрий с ядром и даже их проникновение в кариоплазму. В последние годы стали появляться данные о тесных энергетических связях между митохондриями и ядром[ 5].Это хорошо объясняет наличие околоядерного кластера митохондрий, тесный контакт мембран митохондрий и ядра..
Нами ранее высказывалась гипотеза, что внутриядерные митохондрии это просто результат механического захвата органелл во время абортивного митоза, не завершившегося цитотомией [3].Но окончательно проникновение митохондрий в ядро КМЦ пока трудно объяснить.
К митохондриальным болезням, наследуемым по материнской линии, относятся и кардиомиопатии[1]. В нашем исследовании мы изучали биоптаты больных кардиомиопатиями, пароксизмальными тахиаритмиями, а также экспериментальные модели кардиомиопатий . При экспериментальной адриамициновой и алкогольной кардиомиопатиях обнаруживались аналогичные изменения митохондрий как и у пациентов, а также тесные контакты ядра и митохондрий и проникновение митохондрий в ядро. Хотя генетического исследования пациентов не проводилось, полученные данные наводят на мысль, что при кардиомиопатиях и аритмиях речь идет о мутациях в генетическом аппарате КМЦ. Возникает гетероплазмия – наличие митохондрий как с нормальным, так и с дефектным геномом [1,3]. Характерно, что дефектные митохондрии начинают безудержно пролиферировать, что и приводит к накоплению их в КМЦ, энергетической недостаточности и прогрессированию заболевания.
Оба вещества, применяемые для моделирования адриамициновой и алкогольной кардиомиопатий, являются токсическими и, по-видимому, воздействуют на генетический аппарат КМЦ. Сходные изменения при патологии у пациентов и в эксперименте, подтверждают это предположение.

