При обогащении медных руд, на каждую тонну концентрата образуется до 25-30 т флотоотходов [1]. Вследствие этого на обогатительных фабриках сформировались хвостохранилища, содержащие миллионы тонн отходов. Например в Казахстане только на Балхашской и Джезказганской обогатительных фабриках скопилось ≈1 млрд.т флотоотходов, содержащих не менее 3 млн. т. меди. Для извлечения меди из хвостов обычно используется преимущественно вторичная флотация [2-5]. Однако при этом доизвлекается не более 5 % меди, а нерудная составляющая флотоотходов не рассматривается в качестве сырья для производства товарной продукции. По нашему мнению одним из перспективных методов переработки флотоотходов может стать двухстадийный хлоридно- электротермический метод, предусматривающий на первом этапе извлечение меди в хлоридные возгоны и получение ферросплава из обезмеженного огарка- на втором. Такой метод был применен нами при переработке труднообогатимых руд [6,7].
В статье приводятся результаты исследований по хлорированию находящегося во флотоотходах CuFeS2 хлоридом водорода. Исследования проведены при помощи программного комплекса HSC-5.1, разработанного финской металлургической компании Outokumpu [8]. Благодаря сотрудничеству создателей этого комплекса с европейским консорциумом SGTE (Scientific Group Thermodata Europe), который занимается созданием, поддержкой и распространением высококачественных баз данных, он постоянно совершенствуется и расширяет свою базу данных [9].
Предварительный анализ возможности рассматриваемых реакций (по величине 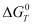 ) проводился с использованием подпрограммы комплекса HSC-5.1 – «Reaction Eguations», а полный термодинамический анализ, основанный на принципе минимума энергии Гиббса- по подпрограмме «Eguilibrium Compositions».
) проводился с использованием подпрограммы комплекса HSC-5.1 – «Reaction Eguations», а полный термодинамический анализ, основанный на принципе минимума энергии Гиббса- по подпрограмме «Eguilibrium Compositions».
Цель работы – определение условий максимальной хлоридовозгонки из CuFeS2 меди и минимальной железа.
В табл. 1 приведена информация о влиянии температури кислорода на хлорирование CuFeS2 по реакциям:
2CuFeS2+4HCl+6,5O2=2CuCl2+ Fe2O3+2H2O+4SO2; (1)
2CuFeS2+4HCl+8,5O2=2CuCl2+ Fe2O3+2H2O+4SO3; (2)
2CuFeS2+4HCl+7O2=2CuCl2+ Fe2O3+H2O+3SO2+SO3. (3)
Таблица 1
Влияние температуры и кислорода на 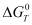 хлорирования CuFeS2
хлорирования CuFeS2
|
Номер реакции |
|
|||||||
|
773 |
973 |
1073 |
1173 |
1273 |
1373 |
1573 |
1773 |
|
|
1 |
-835,3 |
-769,7 |
-736,9 |
-704,0 |
-670,9 |
-637,5 |
-572,5 |
-502,4 |
|
2 |
-887,5 |
-784,7 |
-733,5 |
-682,1 |
-630,7 |
-579,0 |
-475,5 |
-321,6 |
|
3 |
-848,3 |
-779,4 |
-717,4 |
-698,6 |
-660,8 |
-622,9 |
-546,0 |
-420,0 |
Из табл. 1 следует, что с термодинамической точки зрения, равновесие трех реакций сдвинуто слева направо. Причем в температурном интервале 573-1058К наиболее вероятна реакция 2 (с образованием SO3), а затем, при Т≥1058К наиболее вероятная реакция 1 (с образованием SO2). В связи с этим интересна реакция 3, в которой присутствуют SO2 и SO3.
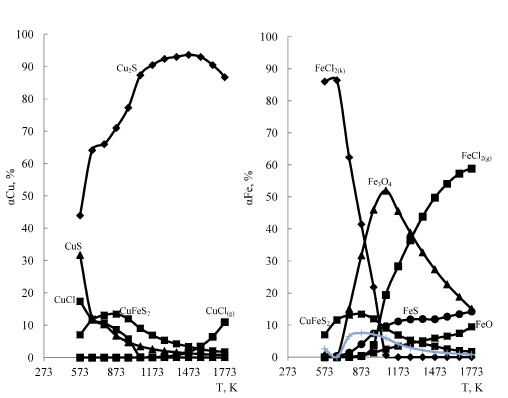
На рис. 1 приведена информация о влиянии температуры на степень распределения меди и железа в системе 2CuFeS2 - 4HCl -7O2 , из которого следует, что в рассматриваемой системе основными медьсодержащими продуктами (в зависимости от температуры) являются конденсированные CuCl2, CuCl, и газообразные CuCl, Cu3Cl3, CuCl2, Cu4Cl4. Кроме того медь в небольшом количестве находится в виде CuО, Cu2О и Cu5Cl2. Из таблицы 2 следует, что медь из CuFeS2 переходит в газообразные хлориды довольно полно (на 98,9-99,9 %) в температурном интервале 1173-1773К.
I – медь, II – железо
Рис. 1. Влияние температуры на степень распределения меди и железа в системе 2CuFeS2 – 4HCl – 7O2 при давлении 0,1 МПа
Таблица 2
Влияние температуры на степень хлоридовозгонки меди в виде Σ CuCl, CuCl2, Cu3Cl3 , Cu4Cl4 , и Cu5Cl5 (α ΣCu)
|
Т, К |
773 |
873 |
973 |
1073 |
1173 |
1273 |
1373 |
1473 |
1673 |
1773 |
|
α ΣCu, % |
0,39 |
5,47 |
15,16 |
70,37 |
98,9 |
99,11 |
99,31 |
99,56 |
99,68 |
99,90 |
Из рис. 1 видно, что основными продуктами взаимодействия в рассматриваемой системе по железу являются Fe2O3, Fe3O4, FeO и газообразные FeCl2 и FeCl3. Причем заметной хлоридовозгонка железа становиться при температуре более 1173 К (табл. 3).
Таблица 3
Влияние температуры на степень хлоридовозгонки железа в виде FeCl2 и FeCl3 (α ΣFe)
|
Т, К |
773 |
873 |
973 |
1073 |
1173 |
1273 |
1373 |
1473 |
1573 |
1673 |
1773 |
|
α ΣFe, % |
0,05 |
0,14 |
0,31 |
0,69 |
1,45 |
2,98 |
6,03 |
11,53 |
19,68 |
30,81 |
54,22 |
Из сопоставления табл. 2 и табл. 3 следует, что при давлении 0,1 МПа для соблюдения условий хлоридовозгонки αΣCu >> α ΣFe процесс необходимо проводить при 1173 К.
О влиянии давления на хлоридовозгонку меди и железа в рассматриваемой системе можно судить из рисунка 2, из которого следует, что уменьшение давления от 0,1 до 0,01 МПа позволит проводить хлоридовозгонку меди при более низких температурах. Уменьшение давления позволяет снизить хлоридовозгонку железа, причем заметно при температуре более 1273 К. Влияние давления на температуру 1 % степени хлоридовозгонки металлов (Тн) показано в табл. 4, из которой следует, что уменьшение давления понижает Тн для меди на 108,7 градусов и увеличивает для железа на 41,1 градус. При этом зависимости ТнСu=f (Р) и ТнFe=f (Р) имеет вид:
ТнСu= 650,73+3561,2Р-2134Р2; (4)
ТнFe= 1162,2-761,0Р+2766Р2. (5)
Таблица 4
Влияние давления на Тн хлоридовозгонки меди и железа
|
Давление, МПа |
0,01 |
0,05 |
0,1 |
|
ТнСu, К |
684,2 |
775,3 |
792,9 |
|
ТнFe, К |
1154,9 |
1131,1 |
1113,8 |
(¾) – медь, (- – -) – железо
1-0, 1 МПа, 2-0,05 МПа, 3-0,01 МПа
Рис. 2. Влияние температуры и давления на степень хлоридовозгонки меди и железа в системе 2CuFeS2 – 4HCl – 7O2
I – медь, II – железо
Рис. 3. Влияние температуры на степень распределения меди и железа в системе 2CuFeS2 – 4HCl −3,5O2 при давлении 0,1 МПа
Из рис. 2 видно, что минимальная температура высокой (не менее 98 %) степени хлоридовозгонки меди при снижении давления от 0,1 до 0,01 МПа уменьшается от 1173K до 700 °С. Полная хлоридовозгонка меди при 0,01МПа не возможна из за образования CuО. Степень хлоридовозгонки железа при этом уменьшается от 1,45 до 0,15 %.
При уменьшении количества кислорода от 7 до 3,5 до кмолей заметная хлоридовозгонка меди отмечается при температуре более 1373-1473 К (0,7-1,2 %). Однако, даже при 1773 К, степень хлоридовозгонки меди не превышает 12 % (рис. 3). Большая часть железа (86,4 %) при уменьшении кислорода уже при 673 К переходит в конденсированный хлорид -FeCl2 (рис. 3). С увеличением температуры более 873 К становиться заметна хлоридовозгонка железа, максимум которой (58,8 %) наблюдается при 1773К. На рисунке 4 приведено влияние давления в системе 2CuFeS2 – 4HCl −3,5O2 на степень хлоридовозгонки меди, из которого следует, что уменьшение давления от 0,1 до 0,01 МПа позволяет увеличить хлоридовозгонку меди до 29,3 % (1500 °С), однако хлоридовозгонка железа при этом остается довольно заметной (53-55 % при 1573-1773 К).
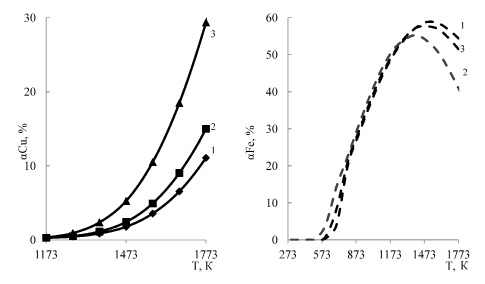
(¾) – медь, (- – -) – железо
1-0,1 МПа, 2-0,05 МПа, 3-0,01 МПа
Рис. 4. Влияние давления на степень хлоридовозгонки металлов в системе 2CuFeS2 – 4HCl –3,5O2
Из сопоставления рис. 2 и 4 следует, что для выполнения условия αхлCu>>αхлFe процесс хлоридовозгонки CuFeS2 хлоридом водорода необходимо проводить с избытком кислорода. Применительно к переработке хвостов обогащения, содержащих халькопирит хлоридовозгонку необходимо проводить при атмосферном давлении и температуре 1173 К.
Полученные результаты по хлоридовозгонке меди из CuFeS2 позволяют сделать следующие выводы:
В системе 2CuFeS2–4HCl-7O2 хлоридовозгонка меди происходит при более низких температурах, в сравнении с железом; температура начала хлоридовозгонки меди уменьшается от 792,9 до 684,9 К при снижении давления от 0,1 до 0,01 МПа; а температура хлоридовозгонки меди не менее 98 % уменьшается от 1173 до 973 К (при этом степень хлоридовозгонки железа уменьшается от 1,45 до 0,15 %)
В системе 2CuFeS2 -4HCl−3,5O2 при 0,1 МПа хлоридовозгонка меди начинается при температуре более 1373-1473 К; при увеличении не приводит к значительному увеличению хлоридовозгонки меди (она не превышает 12 % даже при 1773 К), однако железо при этом хлорируется более полно (до 58,8 %); уменьшение давления до 0,01 МПа способствует увеличению степени хлоридовозгонки меди из CuFeS2, однако она при 1773 К не превышает 30 % .


 , кДж/г·моль Cl2 при температуре
, кДж/г·моль Cl2 при температуре