Геморрагическая лихорадка с почечным синдромом (ГЛПС) – одна из нозоформ хантавирусной инфекции – в странах Евразии этиологически связана с вирусами Хантаан, Пуумала, Сеул, Амур и Добрава (род Hantavirus семейства Bunyaviridae) [10]. В Российской Федерации ГЛПС представляет собой одну из наиболее распространенных природно-очаговых вирусных инфекций и остается актуальной проблемой для здравоохранения. Заболевание нередко протекает в тяжелой форме с летальными исходами (летальность до 1-2 % в европейских и до 5-10 % в дальневосточных районах Российской Федерации), специфические средства профилактики и лечения данной инфекции в настоящее время отсутствуют [4].
Приморский край является одной из эндемичных по ГЛПС территорий и характеризуется ежегодной регистрацией случаев заболевания и высокими показателями летальности (до 15,6 %) [5]. На территории края установлена циркуляция трех возбудителей ГЛПС: хантавирусов Хантаан, Амур и Сеул и двух хантавирусов, чья роль в патологии человека до настоящего времени не установлена (Хоккайдо и Владивосток) [7].
Цель исследования – изучить особенности диагностики ГЛПС в очагах совместной циркуляции нескольких серотипов хантавирусов.
Материалы и методы исследования
За период 2004 – 2013 гг с целью серологической диагностики ГЛПС исследовано 4312 образцов сывороток крови и 791 образец мочи от 3600 больных с различной патологией инфекционной и неинфекционной природы.
Диагноз ГЛПС подтверждали на основании выявления специфических антител в образцах сыворотки крови в непрямом методе флюоресцирующих антител (НМФА) с помощью коммерческого «Диагностикума геморрагической лихорадки с почечным синдромом культурального, поливалентного», в соответствии с инструкцией производителя (ФГУП «ПИПВЭ им. М.П. Чумакова РАМН», г. Москва) и руководствуясь положениями СП 3.1.7.2614-10 [4].
Для подтверждения острого периода заболевания определяли наличие антител класса IgM и IgG, используя коммерческий набор ВектоХанта-IgM и ВектоХанта-IgG (производитель ЗАО «Вектор-Бест», п. Кольцово) согласно инструкции производителя. Также использовали методику определения авидности антител по K. Hedman и соавт. [8]. Кратко, исследуемые сыворотки крови в двукратном разведении, начиная с наименьшего, параллельно наносили на два слайда с антигеном хантавируса. Первое стекло, обозначенное «А» исследовали в НМФА по стандартной методике. Второе, обозначенное «Б» после контакта с исследуемой сывороткой второй раз вместо отмывки в ФСБ pH 7,2 обрабатывали свежеприготовленным 8М раствором мочевины. Учет результатов проводили, высчитывая показатель авидности (К) антител по формуле:
При К ≥ 32, авидность антител по рекомендациям авторов методики, оценивали как низкую, что свидетельствовало об остром периоде инфекции. При показателе К = 16 – как переходную, но ближе к низкоавидной, при показатели К = 8 – как переходную, но ближе к высокоавидной. При К < 4 авидность антител считали высокой.
Для идентификации серотипа хантавируса – возбудителя заболевания использовали реакцию торможения гемагглютинации (РТГА) и реакцию нейтрализации (РН). Для проведения РТГА гемагглютинирующие антигены готовили из культуры клеток Vero-E6, инфицированной хантавирусами Хантаан (геновариант Far East, штамм Aa-79-95), Сеул (штамм Seo 80-39) и Амур (штамм Ap-15-99), с последующей обработкой, согласно стандартной методике с авторскими модификациями [3]. Титром антигемагглютининов считали наивысшее разведение сыворотки крови, которое вызывало задержку гемагглютинации эритроцитов, вызванную действием антигена хантавируса.
Использовали реакцию нейтрализации (РН), основанную на методе выявления фокусобразующих единиц (ФОЕ) в культуре клеток [2]. Монослой клеток Vero-E6, выращивали в 24-луночных панелях. В равных объемах смешивали двукратные разведения сывороток больных ГЛПС, 50-100 ФОЕ вируса и комплемент (1:100) и инкубировали 1 час при 37°С, после чего вышеуказанную смесь вносили на монослой клеток. После дополнительного контакта с клетками при 37°С в течение 1 часа содержимое лунок отсасывали и вносили покрытие 0,4 – 0,6 % карбоксиметилцеллюлозы. После инкубации при 37°С в течение 9-10 дней полужидкое покрытие удаляли и монослой фиксировали абсолютным спиртом. На фиксированный монослой вносили специфические анти-хантавирусные антитела и инкубировали 1 час при 37°С. Далее лунки промывали и вносили меченный пероксидазой хрена белок “А”. После контакта (1 час при 37°С) и отмывки вносили индикаторную систему (0,05 % диаминобензидинатетрахлорида, 0,02 % NiCl2 и 0,01 % Н2О2). Количество инфицированных колоний клеток (ФОЕ) в виде темно-коричневых или темно-серых пятен определяли визуально. Титр вируснейтрализующих антител определяли по 80 % подавлению числа ФОЕ, в сравнении с контролем вируса.
Основанием для постановки этиологического диагноза ГЛПС являлась 4-кратная и более разница в титре гемагглютинирующих или нейтрализующих антител к антигенам гомологичного и гетерологичного вирусов.
Результаты исследования и их обсуждение
За последние десять лет (2004 – 2013 гг) в Приморском крае серологически диагностировано 687 случая заболевания ГЛПС, в том числе 15 летальных случаев. Среднемноголетняя заболеваемость ГЛПС составила 3,4 случая на 100 тысяч населения, в разные годы показатель заболеваемости варьировал от 2,1 на 100 тыс. (2006) до 6,9 на 100 тыс. (2005). Средний показатель летальности составил 2,2 %, летальные исходы, связанные с ГЛПС, регистрировали практически ежегодно, наивысший показатель летальности 9,2 % отмечен в 2007 г. (рисунок).
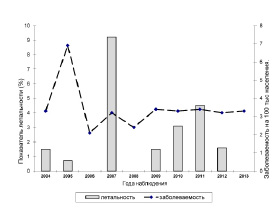
Многолетняя динамика заболеваемости ГЛПС и летальности в Приморском крае
Примерно половина случаев ГЛПС (46,9 %) зарегистрирована среди жителей административного центра Приморского края г. Владивостока (n=322). Среди них 11,5 % работали или отдыхали в пригородной черте, входящей в состав Владивостокского административного городского округа, в том числе, на островах Русский и Попов, где сохранились природные биотопы – ареалы обитания диких грызунов. В то же время 12,7 % заболевших жителей г. Владивостока связывали свое заболевание с выездом в природные очаги края, где трудно исключить контакт с выделениями инфицированных грызунов. Среди жителей 143 населенных пунктов 24 административно-территориальных подразделений Приморского края (13 муниципальных районов и 11 городских округов) зарегистрировано 365 случаев ГЛПС.
От 687 больных ГЛПС исследовано 1254 образцов сывороток крови, в том числе, от 303 больных (44,5 %) для установления/подтверждения диагноза поступила только одна сыворотка крови, при этом в 12,9 % этих единственных сывороток крови титр антител в НМФА не превышал 1:64, что недостаточно для подтверждения диагноза острой инфекции. От 384 больных ГЛПС получены парные сыворотки крови (n=951, в среднем, 2,5 сыворотки крови/человека), однако у 5,2 % больных в парных сыворотках, взятых с недельным интервалом, не отмечалось 4-кратного нарастания титра антител. В сомнительных случаях проводилось исследование авидности специфических антител. В 10,3 % (n=4) единственных сывороток крови с титром 1:64 выявлены антитела высокой авидности, что, с учетом предполагаемого дня заболевания и клинической картины позволило исключить острый характер инфекции, заставляя думать в этом случае о ретроспективной диагностике ГЛПС.
При анализе сывороток крови на наличие других маркеров острой инфекции показано, что уже, начиная с 9 дня, на фоне присутствия антител класса IgM, выявляли антитела класса IgG, при этом в 50 % образцов сывороток, полученных на 10 – 14 день от начала заболевания, титр IgG превышал или был равен титру IgM. Дополнительно подтверждением острой инфекции также служило определение антител к хантавирусам в образцах мочи в НМФА (12,9 % исследованных образцов от больных ГЛПС).
Анализ в РТГА и РН сывороток крови, полученных от 281 больных ГЛПС, не выезжавших за пределы Владивостокского городского округа в течение предполагаемого инкубационного периода (21 день), показал, что в 77,2 % случаев заболевания этиологическая роль принадлежала вирусу Сеул, в 22,8 % случаев возбудителем инфекции являлись вирусы Хантаан или Амур. Больные этой группы, преимущественно были жителями частных домов на окраинах города, пригорода, либо их заболевание было связано с работой или отдыхом в местах, где отлавливались грызуны рода Apodemus, в том числе и на дачных участках. Необходимо отметить, что случаи ГЛПС, связанные с вирусами Хантаан и Амур, регистрировались на территории городского округа за период наблюдения ежегодно (рис.2).
При серодифференциации случаев заболевания ГЛПС, зарегистрированных у жителей районов края, и выезжавших в природные очаги жителей города (n=406), отмечена доминирующая роль двух возбудителей – вирусов Амур и Хантаан (54,7 % и 41,9 % случаев, соответственно), однако в 3,4 % случаев не удалось установить этиологию инфекции (равные титры антител в РТГА и РН к обоим антигенам). Случаев заболевания, связанных с другими серотипами хантавирусов, циркулирующими в крае, не выявлено.
Клиническая картина ГЛПС, ассоциированной с разными серотипами хантавирусами, демонстрирует сходство основных проявлений болезни особенно на ранних этапах заболевания. Генерализованный характер инфекции с вовлечением в патологический процесс различных органов и систем обуславливает полиморфизм симптоматики независимо от этиологического агента. Несмотря на то, что некоторые авторы отмечают связь выраженности тех или иных симптомов с серотипом хантавируса – возбудителя ГЛПС [1], точный диагноз может быть установлен только при серологическом подтверждении.
Нормативными документами регламентируется, что наиболее качественным показателем выявления и этиологической обусловленности заболевания ГЛПС является установление четырех- или более кратного нарастания титров специфических антител в парных сыворотках крови больных, взятых в динамике болезни [4]. Однако на практике, зачастую, невозможно соблюдение всех этих условий, и для диагностики часто доступна только одна сыворотка крови больного с подозрением на ГЛПС. Для верификации диагноза некоторые авторы предлагают определять специфические антитела в других биологических жидкостях (слезная жидкость, моча). Нами показано, что при постановке окончательного диагноза в отдельных случаях эти исследования, в частности, определение антител в моче, могут быть дополнением к исследованию единственной сыворотки крови, но не служить единственным диагностическим критерием. Точно также, использование генетических методов исследования для подтверждения ГЛПС – выявление РНК хантавируса методом ОТ-ПЦР – оправдано, но ограничено сроками виремии, которые достаточно сильно варьируют (от 5 вплоть до 21 дней от начала заболевания)[9].
С учетом условий и места заражения больных в Приморском крае традиционно сложилось деление очагов хантавирусной инфекции на два основных эпидемиологических типа: сельский очаг, природный – возбудители вирусы Хантаан и Амур, носители Apodemus agrarius и A.peninsulae, и городской, антропоургический – возбудитель вирус Сеул, резервуар Rattus norvegicus. Показано, что активизация очагов хантавирусной инфекции происходила при росте численности и инфицированности мышевидных грызунов-носителей хантавируса, однако эти процессы в популяциях полевой и восточноазиатской мышей и серой крысы пространственно и во времени не совпадали, что приводило к межгодовым и внутригодовым различиям особенности эпидемиологии ГЛПС [6]. Такой сложный характер функционирования очагов циркуляции различных хантавирусов в природных популяциях основных носителей – мышевидных грызунов, в том, числе связанный с постоянно меняющимися границами природных биотопов, в частности, из-за активной хозяйственной деятельности человека, не позволяет четко разделить ареалы распространения отдельных серотипов/генотипов хантавируса и установить тип вируса – возбудителя в каждом конкретном случае.
К тому же при сборе эпидемиологического анамнеза у больных довольно часто присутствует указание на несколько мест возможного заражения (грызуны на работе, дома, выезд на природу и т.д.), что затрудняет постановку этиологического диагноза ГЛПС.
Применение таких реакций как РТГА и РН позволяет в большинстве случаев установить типа возбудителя инфекции, однако, в первую очередь, ограничено отсутствием коммерческих тест-систем.
Особое значение серологическая диагностика ГЛПС имеет при расследовании групповых случаев и вспышек заболевания, которые в Приморском крае регистрируются практически ежегодно. Так, в 2010 г. доля групповых случаев в общей заболеваемости составила 20,1 %, включая 9 человек выявленных во время одной вспышки, из них только у 4 течение ГЛПС было «классическим», тяжелым, с манифестацией всех основных синдромов. У оставшихся течение заболевания было средне-тяжелым и легким, заподозрено на основании эпидемиологических данных и подтверждено серологическими методами исследования (НМФА, РТГА и РН).
Выводы
Результаты наших исследований показали, что в ряде случаев только комплексное применение нескольких методов исследования (НМФА, определение авидности, определение классов иммуноглобулинов) позволяет подтвердить или исключить острый период ГЛПС, особенно при доступности от больного одной сыворотки крови.
Использование таких методов как РТГА и РН позволяет установить этиологическую структуру заболеваемости ГЛПС в очагах циркуляции нескольких серотипов хантавирусов. Преимуществом РТГА является возможность использования образцов сывороток крови в достаточно ранние сроки заболевания, однако для более точной диагностики необходимо исследование парных сывороток крови.

