Реологические показатели крови представляют собой сложную систему, на состояние которой большое влияние оказывает функциональный гомеостаз организма [6]. В связи с этим изменения реологии крови при многих нозологических формах значительно микшируется особенностями функционирования разных систем пациента, и его способностью адаптироваться к патологическим воздействиям, что на практике может быть связано с целым рядом социальных и генетических факторов.
Кластерный анализ является статистическим методом позволяющим выявить закономерности, основанные на формировании устойчивых групп изучаемых объектов [2], что на наш взгляд является ключевым в частично детерминированной системе реологических характеристик крови.
Цель исследования выявить варианты адаптивных изменения показателей микро- и макрореологии крови у пациентов с ревматоидным артритом
Материалы и методы исследования
Контрольную группу (группа К) составили 44 практически здоровых пациента (72,7 % женщин и 27,3 % мужчин) в возрасте от 21 до 59 лет (средний возраст – 45,78±1,84 года). В группу больных ревматоидным артритом вошли 85 пациентов (83,2 % женщин и 16,8 % мужчин) в возрасте от 18 до 66 лет (средний возраст – 47,32 ± 0,97), с длительностью заболевания от 1,5 мес. до 37 лет (в среднем 6,9 ± 8,2 лет), проходивших лечение в городском ревматологическом центре. Диагноз ревматоидный артрит (РА) устанавливался в соответствии с критериями Американской Коллегии ревматологов (1987). В исследование включали всех больных РА, исключали пациентов с сопутствующими заболеваниями печени, почек, легких, онкологической, эндокринной патологией. На проведение исследования получено разрешение независимого локального этического комитета. У всех пациентов было получено письменное информированное согласие.
У всех больных РА имел место полиартрит, у большинства суставная форма (79,2 %) II (31,8 %) и III степени активности (67,6 %) по DAS 28, серонегативный вариант (56,6 %). У 81,5 % наблюдался эрозивный артрит. Большинство пациентов имели II (28,9 %) и III (68,2 %) функциональный класс. Системные проявления были выявлены в 20,8 % случаев, в том числе ревматоидные узелки, глазные симптомы, синдром Шегрена, кожный васкулит. Больные РА получали базисную терапию метотрексатом и делагилом, реже другими препаратами; преднизолон в средней дозе 9,5 ± 4,0 мг/сут принимали 46,2 % пациентов, большинство получали нестероидные противовоспалительные препараты (НПВП) – диклофенак, ацеклофенак, реже – селективные ингибиторы ЦОГ-2 (нимесулид, мовалис).
Забор крови для исследования реологических свойств проводился из кубитальной вены утром, натощак, после 12-часового голодания, в качестве антикоагулянта использовался 3,8 % раствор цитрата натрия в соотношении 1:9.
Регистрацию вязкостных характеристик цельной крови и плазмы проводили на ротационном вискозиметре «конус-конус» АКР-2 при постоянной температуре +37,0 ± 0,1°С на скоростях сдвига от 10 до 200 с-1. Определяли содержание гемоглобина и показатель гематокрита стандартными методами.
Процесс сборки линейных агрегатов оценивали с помощью автоматического агрегометра эритроцитов типа МА1 («Myrenne», Германия), разработанного на основе метода Н. Schmid-Schonbein, 1990. Степень агрегации определялась через 5 и 10 секунд после остановки (М5 и М10) и при низкой скорости сдвига 3 с-1 (М15 и М110). Медленный процесс агрегации эритроцитов, связанный с формированием крупных многомерных образований определяли оптическим методом, рекомендованным для использования комитетом экспертов ВОС по стандартизации в гематологии и ICSH (2009), с вычислением среднего размера агрегата (СРА), показателя агрегации (ПА) и процента неагрегированных эритроцитов (ПНА).
Деформируемость эритроцитов изучали фильтрационным методом с использованием автоматического прибора ИДА-4. В качестве показателя деформируемости эритроцитов использовался индекс ригидности (ИР):
ИР=(ts-tb) x 100 / tb x Ht;
где ts – время прохождения через фильтр 250 мкм суспензии эритроцитов; tb – усредненное время прохождения через фильтр 250 мкм ресуспендирующего раствора; Ht – значение гематокрита суспензии в процентах.
Для оценки структурно-функциональных свойств мембраны эритроцитов исследовалась их цитоархитектоника с помощью метода фазово-контрастной микроскопии после фиксации крови в 1 % растворе глютарового альдегида с выделением 10 основных форм по классификации Г.И. Козинца. Первые пять классов эритроцитов (с признаками эхиноцитарной трансформации) принято считать обратимо деформированными, так как эти клетки способны спонтанно восстанавливать форму. Остальные классы эритроцитов относятся к группе необратимо деформированных или предгемолитических форм.
Для выявление устойчивых групп пациентов, характеризующихся общностью изучаемых параметров микро- и макрореологии для всей выборки, включающей в себя группу контроля и пациентов с ревматоидным артритом проводился кластерный анализ. Процедура кластеризации заключалась в выявлении двух кластеров методом К-средних. В последующем для каждого кластера, а также для группы контроля и группы пациентов с ревматоидным артритом определялись: среднее значение каждого показателя, ошибка среднего и дисперсия. Достоверность различия средних определялась при помощи Т-критерия Стьюдента (р<0,05).
Для оценки силы и характера внутренней детерминированности системы реологических параметров крови для исследуемых групп и для выявленных кластеров строились квадратные матрицы коэффициентов ранговой корреляции Спирмена, в которые заносились только достоверные (р<0,05) коэффициенты корреляции. Для оценки степени коррелированности системы параметров, для каждой группы и кластера строились гистограммы распределения коэффициентов корреляции.
В последующем на основе анализа данных квадратных матриц и результатов Т-критерия Стьюдента выявлялись статистически достоверные различия в реологических показателях, корреляция которых низка или отсутствует.
Результаты исследования и их обсуждение
В результате проведенного кластерного анализа была выявлена компактная группа из 15 пациентов (кластер А) в которую вошли только больные РА, в кластер Б вошли остальные случаи (группа контроля и частично больные РА). В последующем нами изучались особенности кластера А, в сравнении с контрольной группой и группой больных РА без пациентов вошедших в кластер А (группа Б).
На первом этапе настоящей работы были изучены особенности изменений реологических свойств крови у пациентов группы Б по сравнению с группой К. Наблюдались выраженные изменения гемореологических показателей. В первую очередь повышалась вязкость плазмы с 1,83±0,03 мПа⋅с до 2,14±0,04 мПа⋅с (р<0,001). Повышение вязкости крови наблюдалось только на высоких скоростях сдвига (В-50, 100, 200), без существенных изменений вязкости крови на низких скоростях сдвига (В-20, 10). Достоверно снижался показатель гематокрита и содержание гемоглобина в крови в группе Б до 38,37±0,46 % и 122,95±1,90 г/л при 41,14±0,44 % и 136,46±1,92 г/л в группе К (р<0,001). При анализе показателей агрегации эритроцитов выявлено, что больные РА по сравнению с практически здоровыми лицами имели усиление процесса агрегации, особенно в первые пять секунд М(5), М1(5). Усиливался и медленный процесс агрегации эритроцитов с образованием более крупных агрегатов. Показатель агрегации в среднем составлял 1,90±0,05 при 1,47±0,04 в контроле (р<0,001), а средний размер агрегата – 6,12±0,09 при 5,55±0,10 (р<0,001). При анализе морфологических форм эритроцитов было выявлено уменьшение количества дискоцитов за счет повышения доли как обратимых, так и необратимых форм клеток с преобладанием стоматоцитарной трансформации мембраны. В группе Б по сравнению с контролем, уровни дискоцитов, обратимо и необратимо деформируемых форм эритроцитов составили соответственно 76,54±1,27 %, против 85,83±1,18 % (р<0,001); 13,08±0,45 % против 9,67±0,45 % (р<0,005); 10,54±0,64 % против 4,28±0,39 % (р<0,001). Способность эритроцитов к деформации в группе Б была хуже, что отразилось повышением индекса ригидности эритроцитов с 54,78±3,74 до 81,77±7,33 (р<0,002). Вышеперечисленные изменения реологических функций эритроцитов в группе Б привели к снижению газотранспортного потенциала, что подтверждается достоверным снижением индекса эффективности доставки кислорода к тканям (ТO2), от аналогичного показателя в группе практически здоровых лиц (7,28±0,07 и 8,19±0,06 соответственно) (р<0,001).
В результате проведённого исследования можно предположить следующую последовательность явлений в системе кровообращения определяющих эффективность её функционирования при данном патологическом состоянии организма. Повышение вязкости плазмы в группе Б может быть связано с изменением содержания в циркулирующей крови широкого спектра провоспалительных веществ, включая гормоны, простагаландины, отдельные белковые фракции, например, глобулины, фибриноген, его дериватов и другие белки с большой молекулярной массой. Эти белки плазмы способны адсорбироваться на поверхности мембраны эритроцитов, изменяя ее вязко-эластические свойства. Высокомолекулярные белки плазмы, такие как фибриноген и макроглобулины, обеспечивают образование молекулярных мостиков, способствуя преодолению сил электростатического отталкивания между клетками [10]. В литературе указывается, что адсорбция к наружной поверхности клетки может осуществляться либо к заряженным группировкам мембранных белков, либо к фосфолипидам. Чем больше сиаловых кислот связанных с белками имеется на поверхности красных клеток крови, тем меньше возможность адсорбции высокомолекулярных белков. При циркуляции в сосудистой системе клетки подвергаются различным воздействиям, которые изменяют биохимический состав и структуру мембран, в первую очередь это касается потери сиаловых кислот. Все это приводит к закономерному увеличению адсорбционных характеристик эритроцитов. Следствием повышенного содержания на поверхности эритроцитов заряженных группировок и повышения сил взаимодействия между ними является формирование конгломератов клеток. Однако отсутствие увеличения вязкости крови при низких скоростях сдвига (20 с-1 и 10 с-1) в группе Б свидетельствует о приспособительном характере этих изменений. Вязкость крови на высоких скоростях сдвига, которая зависит от жесткости мембраны, внутренней вязкости и геометрии клеток в группе Б существенно повышалась. Наиболее вероятной причиной этих изменений является изменение формы клеток [6]. При воздействии различных патологических факторов дискоциты трансформируются в сферы, причем этот переход может осуществляться как путем эхиноцитоза, так и стоматоцитоза. Конечный этап трансформации – сфероцит – представляет собой наиболее жесткую структуру, обычно предшествующую разрушению клетки. Повышение доли эритроцитов с переходной формой не рассматривается как тяжелое патологическое изменение. Эти клетки сохраняют общую дискоидную структуру и при определенных благоприятных условиях могут претерпевать обратный переход в дискоциты [8]. Скорее всего, именно такая трансформация преобладала в группе Б. Адсорбированные на поверхности мембраны эритроцитов белки плазмы, так же способны изменять ее вязко-эластические свойства, что в свою очередь нарушает деформируемость клеток. Деформируемость является лимитирующим фактором продолжительности жизни эритроцитов. По мере старения пластичность эритроцитов уменьшается, в крови появляются клетки с измененной формой, что является одной из причин задержки, деструкции и лизиса их в ретикулярной ткани селезенки [9]. Между двумя ведущими макрореологическими характеристиками концентрацией эритроцитов и вязкостью крови существует высокая степень взаимосвязи. В группе Б на фоне повышения вязкости крови показатель гематокрита и конценрация гемоглобина снижаются. Можно полагать, что у этих больных включаются компенсаторные механизмы, заключающиеся в элиминации из циркуляции поврежденных клеток. Подтверждением этого предположения служит существенное снижение гематокрита и концентрации гемоглобина в крови.
На втором этапе исследования нашей задачей было изучение особенностей изменений реологических свойств крови у пациентов кластера А по сравнению с группой Б. Вязкость плазмы крови больных кластера А практически не отличается от показателей группы Б. При этом повышение вязкости крови на высоких скоростях сдвига (В-50, 100, 200) было еще более существенное и достоверно отличалось от группы Б (р<0,05), а вязкость крови на низких скоростях сдвига (В-20, 10) значительно превышала ее значения у практически здоровых людей (р<0,05). Показатель гематокрита и содержание гемоглобина в крови для кластера А были выше 41,19±0,83 % и 136,33±3,66 г/л, чем в группе Б 38,37±0,46 % и 122,95±1,90 г/л (р<0,01). Анализируя процесс агрегации эритроцитов выявлено, что у больных кластера А по сравнению с группой Б показатели процесса агрегации несколько выше, но эти различия не достоверны. Вместе с тем наблюдается тенденция ослабления медленного процесса агрегации эритроцитов со снижением размеров агрегатов. При анализе морфологических форм эритроцитов было обнаружено большее количество клеток с эхиноцитарной трансформацией и предгемолитических форм. Обращает на себя внимание значительно (в 3,2 раза) более низкая способность эритроцитов к деформации, что отразилось повышением индекса ригидности эритроцитов с 81,77±7,33 в группе В до 263,25+29,14 в кластере А (р<0,001). Газотранспортная функция крови у больных кластера А не имела отличия от группы В.
Данный этап исследования показал, что для кластера А помимо плазменных факторов большое влияние на реологическое поведение крови оказывает состояние красных клеток крови. Морфо-функциональная организация клеточных мембран является основополагающим фактором реализации патологических состояний. Увеличение клеток на последней (необратимой) стадии трансформации, которая связана с потерей мембранного вещества, приводит к напряженному состоянию эритрофагоцитоза. Поврежденные клетки не успевают элиминироваться, что проявляется более высокими эритроцитарными показателями (гематокрит и концентрация гемоглобина). Известно, что перемещение в сосудах микроциркуляции возможно только при сохраненной способности эритроцита к деформации. Определяющее значение для деформируемости эритроцитов имеют вязкостно-эластичные свойства мембраны, которые определяются, прежде всего, состоянием спектрина, актина и других интегральных белков эритроцитарной мембраны и их взаимодействием с другими структурными элементами мембраны [5]. В поддержания нормальных физико-химических свойств мембраны важная роль принадлежит АТФ-зависимым системам. Метаболическое истощение приводит к инактивации работы Nа+/К+-насоса и последующему накоплению Са2+ и уменьшению К+ в клетке [6]. Повышение концентрации несвязанных ионов Са2+ обусловливает их взаимодействие с белками мембраны, вызывая их перегруппировку, агрегацию или фосфорилирование, а за счет сократительной реакции спектрина и уменьшения площади поверхности внутреннего липидного слоя приводит к образованию эхиноцитов. Важную роль в поддержании формы эритроцитов и снижении ригидности клеток играет белок полосы 3, анионный обменник Cl-/ HCO3-. Ингибирование анионного потока способствует эхиноцитарной или стоматоцитарной трансформации. Наряду с цитоскелетом эритроцитов, который осуществляет регуляцию стабильности мембраны посредством взаимодействия цитоскелетных белков и трансмембранных белков, в поддержании механических свойств мембраны свой вклад вносит асимметрия билипидного слоя. Поддерживает эту ассиметрию Mg2+-АТР-зависимые ферменты. Модификации, например, фосфорилирование этих белков приводит к утрате нормальной дискоидной формы эритроцитов. Снижение содержания АТФ и высокая концентрация ионов Ca2+ ведут к изменениям метаболизма липидов, увеличению уровня ацилглицеринов и нарушению асимметрии фосфолипидов [1]. Кроме того, такие эритроциты с повышенной жесткостью легко адгезируются к стенке микрососудов и создают зоны ишемии [7]. Активация свободнорадикальных процессов в зоне ишемии обуславливает гемореологические нарушения, реализуемые через повреждение циркулирующих эритроцитов (потеря мембранных липидов, деструкция ее липидного компонента повышение жесткости билипидного слоя, агрегация мембранных белков, перекрестное сшивание спектрина и гемоглобина). Сдвиг pН в сторону ацидоза активирует в эритроцитах дифосфоглицератфосфатазу и ингибирует 2,3-дифосфоглицератмутазу, что обуславливает снижение уровня в них 2,3-дифосфоглицерата и уменьшает его долю, связанного со спектрином, ухудшая эластичность мембраны эритроцитов. Возросшая ригидность эритроцитов обуславливает увеличение вязкости крови, что требует роста энергозатрат сердца на обеспечение продвижения крови по сосудистому руслу [5]. Ухудшение деформируемости эритроцитов в кластере А, по-видимому, не имеет адаптивного значения и, вероятно, отражает несостоятельность защитно-приспособительных реакций системы транспорта кислорода (срыв компенсаторных возможностей механизмов этой системы). Повышение ригидности клеток сдвигает прооксидантно-антиоксидантное состояние организма в сторону активации перекисного окисления липидов. Возникает порочный круг: снижение деформируемости клеток ухудшает транспорт кислорода в ткани, а это в свою очередь, обуславливает еще более выраженное нарушение этого показателя красных клеток крови. Это позволяет рассматривать этот показатель как интегральный критерий не только тяжести нарушений кислородного обеспечения, но и прооксидантно-антиоксидантного состояния организма. Таким образом, выделение ряда пациентов в кластер А связано с перестройкой функциональных гемореологических связей обеспечивающих гомеостаз, а именно возникновение грубых нарушений структурной организации мембран красных клеток крови, что отразилось увеличением ригидности эритроцитов и ростом числа необратимо деформированных форм. Это позволяет использовать данные показатели в качестве маркеров более тяжелых гемореологических нарушений.
При проведении кластерного анализа одной из ключевых задач является интерпретация его результатов – выявление причин, приведших к разделению изучаемой совокупности на устойчивые группы. Мы предполагаем, что выделение больных в кластер А, вызвано иным типом функциональных связей в системе реологических параметров крови, связанных с развитием процессов функциональной декомпенсации.
Третий этап исследования – проведение кластерного анализа в комплексе с корреляционным [3] позволяет подтвердить разный набор функциональных гемореологических связей обеспечивающих гомеостаз в изучаемых группах и кластере.
Данные корреляционного анализа свидетельствуют об изменении характера взаимоотношений в системе. В группе Б по сравнению с контрольными показателями отмечается тенденция к росту положительных корреляций в системе (коэффициент асимметрии для матрицы корреляций контрольной группы – 0,57, а для группы Б – 0,17) также растет как количество и сила корреляционных связей (среднее значение для матрицы корреляций контрольной группы – 0,13, а для группы Б – 0,2). При этом отмечается значительное снижение количества слабых и недостоверных корреляционных связей (значение эксцесса для матрицы корреляции контрольной группы – 0,72, а для группы Б – 0,93).
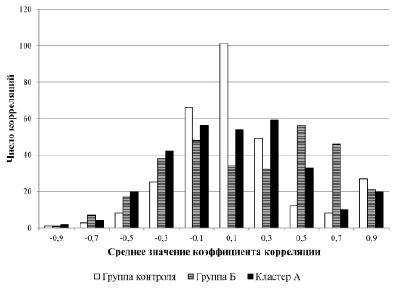
Рис. 1. Гистограмма количества коэффициентов ранговой корреляции Спирмена
Изменения показателей корреляционной матрицы кластера А по сравнению с контрольными показателями не столь выражены, и однотипны с группой Б: коэффициент асимметрии составил – 0,23, а эксцесс – 0,21. Однако при этом наблюдается снижение среднего значения коэффициента корреляции до 0,1. Это можно интерпретировать как возникновение группы сильных отрицательных взаимосвязей, что визуально подтверждается данными гистограммы (рис. 1).
Увеличение положительных корреляций в группе Б, на наш взгляд, может свидетельствовать о подключении дополнительных физиологических механизмов регуляции и авторегуляции гомеостаза реологических показателей крови не задействованных в покое. Значительное же снижение эксцесса до – 0,93 на наш взгляд является проявлением поливариантности адаптационных и дезадаптацинных механизмов при возникновении патологии. Изменения для кластера А, можно трактовать, не столько как подключение, а скорее как замену одних корреляционных взаимоотношений выявленных в контрольной группе, на новые. Причем, последние приобретают отрицательный характер, что может свидетельствовать об их деструктивной роли.
Изучение организации и функционирования биологических систем может потребовать выявления и изучение взаимосвязей между их ключевыми элементами [4]. Для выявления особенностей взаимоотношений параметров в кластере А и группе Б, в отличии от контрольной группы нами были построены корреляционные плеяды (рис.2). Часть корреляций являющихся общими для всех изучаемых групп была вынесена в отдельную диаграмму (рис. 2А). Последние, на наш взгляд, связаны с физическими законами, определяющими изучаемые параметры. На рис. Б представлены связи характерные для группы контроля. Они выявляют функциональные взаимосвязи между полом и гематокритом, содержанием гемоглобина и вязкостью крови на низких скоростях сдвига; между гематокритом и показателями агрегации эритроцитов (рис. 2Б), которые утрачиваются в группе Б.
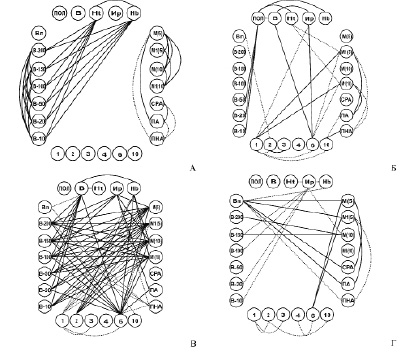
Рис. 2. Корреляционные плеяды. Достоверные положительные связи обозначены непрерывной линией. Достоверные отрицательные связи обозначены пунктирной линией. ПОЛ – пол пациентов. В – возраст пациентов. Ht – гематокрит. Ир – индекс ригидности. Hb – гемоглобин. Вп – вязкость плазмы. В – 200, В – 150, В – 100, В – 50, В – 20, В – 10 – вязкость крови при соответствующей скорости сдвига в секундах -1. М (5), М1 (5), М10 и М1 (10) – показатели агрегации эритроцитов при стазе и скорости сдвига 3 с -1, через 5 и 10 секунд, соответственно. СРА – средний размер агрегата; ПА –показатель агрегации; ПНА – процент неагрегированных эритроцитов; 1 – дискоциты; 2 – эритроциты с одним выростом; 3 – эритроциты с гребнем; 4 – эхиноциты; 6 – стоматоциты; 10 – предгемолитические формы
Для группы Б (рис. 2В) характерна тесная взаимосвязь между показателями вязкости крови, агрегацией эритроцитов и количеством стоматоцитов. Выше приведенные характеристики формируют мощную корреляционную плеяду с множеством сильных корреляций, объединяющую все показатели группы Б в единую систему. При этом отмечается взаимосвязь этих параметров с количеством эхиноцитов и индексом ригидности. Для этой группы характерно возникновение достоверного влияния возраста пациентов на вязкостные показатели крови. Также появляется взаимосвязь между гемоглобином и показателями агрегации и формы эритроцитов, отсутствующая в контрольной группе. Такая консолидация гемореолгических параметров может свидетельствовать об объединении системы для адаптации к действию неблагоприятного фактора с помощью различных приспособительных механизмов. Напряженное состояние адаптивных механизмов вероятно связано с включением функциональных резервов. Это интерпретируется нами как соответствие компенсаторной реакции воздействию изучаемого фактора. Вероятно, определяющее значение в этой группе принадлежит изменению вязкости плазмы в результате повышения содержания в ней провоспалительных веществ, адсорбирующихся на поверхности эритроцитов и показатель гематокрита, который компенсирует негативное повышенной вязкости.
В кластере А (рис. 2Г) происходит разделение единой системы гемореологических параметров крови, на три подсистемы, не связанные корреляционными связями: вязкость крови и деформируемость эритроцитов, вязкость плазмы и агрегация эритроцитов и морфология эритроцитов. Кроме того, происходит изменение характера взаимосвязей индекса ригидности с достоверных положительных на отрицательные. Меняется взаимосвязь с такими параметрами как: показатель гематокрита и концентрация гемоглобина, что позволяет говорить о мощном системообразующем влиянии ригидности эритроцитов в кластере А. Кроме того возникают новые (по сравнению с группой Б и контролем) корреляции между вязкость плазмы и показателями агрегации. Отсутствие взаимосвязей между компонентами единого гемореологического баланса организма, на наш взгляд является следствием подключения ряда факторов меняющих не только состав и вязкость плазмы, но и вызывающих существенные изменения в функциональном состоянии трансмембранных белков и белков цитоскелета (повышение ригидности) и в ассиметрии билипидного слоя мембран эритроцитов (трансформация мембраны).
Заключение
Таким образом, при помощи кластерного и корреляционного анализа были выявлены два варианта гемореологических перестроек, возникающих на фоне ревматоидного артрита, сопровождающихся разным сочетанием компенсаторных процессов. Определены функциональные взаимосвязи и гемореологические маркеры, характеризующие каждый вариант адаптации, такие как повышение вязкости плазмы и усиление процессов агрегации – для группы Б и повышение индекса ригидности и доли необратимо трансформированных эритроцитов – для кластера А. Созданы предпосылки для изучения более тонких клинических, патологических и физиологических механизмов, приводящих к формированию описанных выше вариантов гемореологических перестроек.

