Сахарный диабет (СД) – самое распространенное эндокринное заболевание, являющееся острейшей медико-социальной проблемой, относящейся к приоритетам национальных систем здравоохранения практически всех стран мира (Балаболкин М.И., 2000). Актуальность сахарного диабета (СД) определяется исключительно быстрым ростом заболеваемости.
Цель исследования: провести обзор литературы с оценкой состояния проблемы патогенеза, этиологии и диагностических критериев сахарного диабета 1 типа.
Материалы и методы исследования
По литературным данным нами было проанализирована распространенность сахарного диабета 1 типа за последние три десятилетие с определением основных закономерностей существующих тенденций.
Результаты исследования и их обсуждение
По оценкам экспертов, число больных на нашей планете в 2000 г. составило 175,4 млн., в 2010 г. увеличилось до 239,4 млн. человек, а по прогнозам специалистов к 2030 году их станет уже 438,4 миллиона (рисунок). Совершенно очевидно, что прогноз специалистов о том, что число больных диабетом за каждые последующие 12-15 лет будет удваиваться, оправдывается.
Распространенность инсулинзависимого (ИЗСД) сахарного диабета в различных странах мира различна. Скандинавские страны, и прежде всего Финляндия, занимают лидирующее положение по распространенности диабета I типа, частота же ИЗСД в России (данные по Москве) более чем в 6 раз ниже, чем в Финляндии.
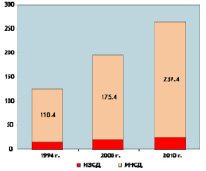
Заболеваемость сахарным диабетом в мире и прогноз его развития (млн. человек)
В России в 1997 г. зарегистрировано примерно 2100 тыс. больных диабетом, из них 252 410 человек СД I типа, 14 367 детей и 6494 подростка. Но эти показатели отражают состояние заболеваемости по обращаемости, т.е. когда больные были вынуждены обратиться за помощью. При отсутствии диспансеризации, активного выявления больных, основная масса страдающих СД остается не учтенной. Люди с гликемией от 7 до 15 ммоль/л (норма 3,3 – 5,5 ммоль/л) живут, работают, конечно, имея характерные симтомокомплексы, не обращаются к врачу, остаются не учтенными. Выборочные эпидемиологические исследования показали, что в развитых странах мира на одного обратившегося к врачу больного приходится 3-4 человека с уровнем сахара в крови 7-15 ммоль/л, не подозревающих о болезни. При первичном обращении больных диабетом I типа мы обнаружили исключительно высокую распространенность поздних диабетических осложнений.
Наиболее тяжелой формой диабета является СД 1 типа. Несмотря на то, что его доля среди всех форм диабета составляет не более 10-15 %, именно СД 1 типа относят к важнейшей медико-социальной проблеме здравоохранения, так как это заболевание нередко возникает в детском и юношеском возрасте, характеризуется тяжестью течения, ранней инвалидизацией и смертностью [1]. СД занимает одно из первых мест как причина слепоты, которая наступает в 25 раз чаще, чем в общей популяции (Калинин А.П. и др., 2010). Поэтому изучение состояния зрительного анализатора при сахарном диабете 1 типа имеет особую актуальность. К настоящему времени доказано, что при СД поражаются все структуры зрительного анализатора. В основе зрительных расстройств при СД лежат патологические изменения на различных отрезках периферической части зрительного анализатора – в области сетчатки, зрительного нерва, хиазмы.
Наиболее популярной теорией патогенеза сахарного диабета (СД) 1 типа в течение последних 20 лет являлась теория, предложенная в 1986 г. G. Eisenbarth [16]. Согласно этой концепции СД 1 типа развивается у генетически предрасположенных лиц. Инициаторам начала аутоиммунных процессов являются факторы внешней среды. Начальная стадия СД 1 типа – гибель островковых клеток – протекает бессимптомно, но может быть выявлена с помощью определения аутоантител. Только на последних стадиях процесса, когда подавляющее большинство р-клеток погибает и возникает абсолютная недостаточность инсулина, появляются клинические признаки диабета. В начале 1970-х годов исследования, проведенные J.Nerup и др. учеными, показали взаимосвязь системы HLA и заболеваемости СД 1 типа. Изначально генетика СД 1 типа представлялась относительно простой: при наличии определенных аллелей генов системы HLA доминирование заболевания было практически полным. Затем пришло понимание так называемого «генетического кошмара» диабета 1 типа. На сегодняшний день известно более двух десятков локусов и 100 генов-кандидатов, имеющих различную степень влияния на развитие СД 1 типа [24]. На протяжении последних десятилетий было исследовано множество факторов окружающей среды с целью выявления достоверного кандидата, влияющего на заболевание СД 1 типа [10]. На первых порах такими кандидатами считались вирусы [23]. В начале и середине 80-х годов прошлого столетия указывалось на значение продолжительности грудного вскармливания [11]. В качестве причины заболевания называлось употребление коровьего молока или искусственное вскармливание [22].
Однако исследование, проведенное в 2003 г. М.А. Atkinson [13], не подтвердило тот факт, что 100 % субъектов, страдающих СД 1 типа, имеют антитела против молекулы BSA (bovine serum albumin) [25]. По последним данным, развитие анти-р-клеточного аутоиммунитета связано с выбором времени включения в рацион питания младенцев зерновых [8,23], употребление заменителей сахара, кофеина и даже копченой рыбы [21]. Важная роль отводится природному компоненту; между различными регионами мира наблюдается разница в частоте заболеваемости СД 1 типа до 500 раз [27]. В 1974 г. была опубликована статья G.F. Bottazzo с описанием антител к островковым клеткам (ICA) [21]. Именно эта дата признается многими как дата установления аутоиммунного характера СД 1 типа. Более чем 30 лет тесты на ICA оставались одним из основных методов исследования при изучении СД 1 типа. Данный метод оказался наиболее удачным как в диагностике заболевания, так и при выявлении лиц с повышенным риском развития диабета. Исследования, посвященные профилактике заболевания, были бы невозможны без определения ICA. Однако в настоящее время считается, что первичным гуморальным маркером являются аутоантитела к молекуле инсулина, а не ICA [20,21]. Аутоантитела к инсулину (IAA) характеризуются высокой чувствительностью, ранним появлением и быстрым исчезновением. Их кратковременное появление может быть маркером обнаружения других антител в более поздние сроки. В целях повышения достоверности результатов необходимо использование различных групп антител.
Сформировалось мнение, что симптомы СД 1 типа обычно проявляются, когда 90–95 % р-клеток погибли [19]. Исследования доктора W. Gepts, проведенные на патологоанатамическом материале, частично подтверждают этот факт [22]. Тем не менее, как показали последние исследования, секреция инсулина в ходе тестов со смешанным питанием у больных с впервые выявленным СД составляет половину по сравнению с контрольной группой здоровых людей. Человек при рождении имеет 100 % или почти 100 % «нормальных» своих р-клеток. До настоящего времени в силу практических трудностей все еще невозможно точно определить у человека островковую клеточную массу in vivo или ex vivo, в опубликованной по данному вопросу литературе также много расхождений [19].
Крайне важной является проблема нарушения регуляции иммунного ответа в отношении собственных клеток (р-клеток), т. к. иммунная система оказывает влияние на процесс заболевания задолго до появления клинических симптомов сахарного диабета. Последние исследования говорят о том, что нарушения нормальной регуляции аутореактивного и аутопротективного иммунного ответа могут являться результатом неправильного функционирования популяции Т-клеток, которые распознаются по экспрессии молекулы СД 25 [27].
С учетом новых данных М. Atkinson и G. Eisenbarth опубликовали современную теорию патогенеза СД 1 типа [18,17]. Вместо генетической предрасположенности в ней отмечается взаимодействие между генами, способствующими и препятствующими развитию СД 1 типа. Кроме того, рассматривается факт, что эти гены фактически влияют на восприимчивость и сопротивляемость к СД 1 типа в ходе всего периода, предшествующего заболеванию диабетом, а не только в период, предшествующий аутоиммунной индукции. При оценке влияния факторов окружающей среды на развитие сахарного диабета 1 типа рассматриваются различные природные процессы, оказывающие воздействие на течение диабета за весь период заболевания, включая и его доклиническую стадию, а не только фактор, провоцирующий клинический дебют заболевания, например вирусная инфекция.
Другим аспектом, который необходимо пересмотреть, является феномен потери р-клеток; есть вероятность того, что ее выраженность будет существенно изменяться в зависимости от типа инсулита, степени гибели р-клеток и их способности к регенерации [22]. В настоящее время до конца неясным остается механизм аутоиммунной реакции, предваряющей распад р-клеток, в особенности реакция р-клетки на аутоиммунные антитела.
Исходя из современных представлений о патогенезе СД 1 типа, гибель р-клеток может происходить в результате разных патологических процессов. Один из них – деструкция или некроз р-клеток, другой – апоптоз или генетически запрограммированный процесс гибели клеток. В последние годы было показано, что процессы некроза и апоптоза не противостоят друг другу. Важную роль в процессе клеточной гибели играют цитокины – секреторные белки, выполняющие функцию медиаторов межклеточных сигналов и основных регуляторов активности иммунной системы.
В большинстве исследований, посвященных СД 1 типа, направленных на изучение нарушений функций иммунной системы, использовалась в качестве материала кровь из периферических вен, в то время как очагом хронического воспаления при диабете является поджелудочная железа. Очевидно, что подобная разница при исследовании материала вызывает немалое количество ошибок и артефактов [13,9].
В ходе практических исследований, посвященных профилактике заболеваемости, существует много препятствий. Среди них этические аспекты, включающие желание пациентов знать о развитии заболевания в будущем, возможность проведения такого рода скрининга при отсутствии методов предупреждения заболеваемости СД 1 типа, нарушение конфиденциальности, вопросы организации практического осуществления скрининга и, конечно, финансовые барьеры [20]. Первоначальный оптимизм исследователей, касающийся идентификации метода предупреждения заболеваемости СД 1 типа при использовании животных моделей, привел как к открытиям, так и к разочарованиям в отношении применения аналогичных методов у человека.
Сорок лет назад было отмечено, что в поджелудочной железе больных с недавно диагностированным СД 1 типа островковые клетки начинают отсоединяться от панкреатических протоков. Кроме того, р-клетки, способные секретировать инсулин, были выявлены в поджелудочной железе больных, которые страдали СД 1 типа даже длительное время. Очевидно, что существует потенциал эндогенно-регенеративной способности р-клеток. Начало гипергликемии действительно может ассоциироваться с большей островковой клеточной массой, чем полагали ранее.
Перспективным представляется изучение способности р-клеток к регенерации и рассмотрение модели регенерации островковых клеток у больных с впервые выявленным СД 1 типа.
На протяжении многих лет доказывается значимость при разных заболеваниях аутоиммунного процесса, для подтверждения которого определяют антитела к основному белку миелина (ОБМ) – одному из главных структурных, нейроспецифических белковых компонентов миелина, входящих в состав периферических нервных волокон и белого вещества головного и спинного мозга, который составляет около 30 % общего содержания протеинов в миелине [4,7]. В этой связи были проанализированы возможные происходящие аутоиммунные процессы при сахарном диабете 1 типа и оценена их активность. В этой связи проведенные исследования, связанные с определением антител к ОБМ указывают на процессы демиелинизации при СД [4,6]. ОБМ является наиболее иммуногенным и на него направлены многие аутоиммунные реакции. Кроме того, нарушение его метаболизма связывают с развитием демиелинизирующего процесса. Проведенные ранее исследования подтвердили важнейшую роль аутоиммунных нарушений в патогенезе сахарного диабета 1 типа. Отмечено достоверное повышение титра антител к ОБМ в сыворотке крови. Результаты исследования позволяют утверждать, что антитела к ОБМ могут служить уникальными маркерами аутоиммунного процесса демиелинизации периферической нервной системы и быть дифференциально-диагностическим критерием качества проведенной терапии у пациентов с сахарным диабетом 1 типа.
Для уточнения степени поражения периферической нервной системы и, в частности зрительного анализатора, используют метод вызванных потенциалов, что позволяет объективно оценить состояние проводящей системы зрительного анализатора от сетчатки до коры головного мозга давая возможность количественно оценить скорость проведения по зрительному анализатору по черно-белому и цветному спектру видимого света. Использование данной методики по мнению авторов [2,3,5,6] позволяет проводить раннюю диагностику неврологических осложнений СД 1 типа.
Более известным осложнением СД является диабетическая энцефалопатия, приводящая к когнитивному снижению [2,3]. Когнитивная дисфункция приводит не только к ухудшению качества жизни пациентов, нарушая их социальную активность, но также снижает способность адекватного контроля за течением болезни и, следовательно, увеличивает риск развития грозных осложнений, приводящих к тяжелой инвалидизации (Чугунов П.А., Семенова И.В., 2008). Несмотря на большое число работ посвященных изучению когнитивной сферы больных СД, до сих пор не сформировано единое представление о когнитивных нарушениях (КН) при этом заболевании. Таким образом, в настоящее время, несмотря на растущую актуальность проблемы диабетических осложнений остается большое число вопросов, требующих уточнения.
Все вышеизложенное свидетельствует о необходимости дальнейшего углубленного изучения неврологических нарушений при сахарном диабете 1 типа.

