К одним из насущных проблем лечения неинвазивного рака мочевого пузыря (НРМП) относится снижение частоты рецидивирования, выявляемого у 80 % пациентов, а также уменьшение более чем у 20 % вероятности прогрессирования процесса. Известно, что почти у 50 % больных НРМП рецидив развивается в течение первых двух лет с момента проведения трансуретральной резекции (ТУР) , начиная со сроков 4–6 месяцев [1, 3]. Для предотвращения такого нежелательного течения НРМП разработана адъювантная внутрипузырная химиотерапия (ВПХТ) [5]. Высокую противорецидивную эффективность демонстрирует противоопухолевый препарат гемцитабин, оказывающий влияние на опухолевые клетки, но при этом не вызывая выраженного токсического действия на нормальную ткань мочевого пузыря, гемодинамику и самочувствие пациентов [6]. По сравнению с другими вариантами противорецидивной терапии (иммунотерапия БЦЖ) гемцитабин проявляет схлдное по эффетивности действие, однако не ликвидирует проблему возникновения рецидивов полностью [6]. В связи с этим в онкоурологии наметился путь к повышению результативности ВПХТ через механизмы воздействия различных физических факторов, повышающих эффект проникновения химиопрепаратов в опухолевые клетки. Действительно, вероятность наличия опухолевых клеток после ТУР обуславливается диффузным характером неопластических изменений уротелия, наличием рак in situ (CIS), возможностью имплантации опухолевых клеток во время операции. Чтобы усилить избирательное действие химиопрепарата применяется СВЧ-гипертермия [10], электромагнитные излучения оптического диапазона – лазер, сонотерапия и фотодинамическая терапия [9]. В диапазоне сверхнизкочастотных магнитных полей особенно эффективным проявился режим сканирования частот (СК МП), воспроизводимый с помощью микропроцессорного магнитнотерапевтического аппарата « Градиент-4М» [4]. Также воздействие на эксперементальные модели опухолей in vitro и in vivo способствовало значительному проникновению вглубь опухолевых клеток цисплатина и доксорубицина, а также потенциалочувствительных зондов аниона АНС и катиона ДСМ. Причем катионы – ДСМ и доксорубицин накапливались в опухолевых клетках из омагниченных опухолей в среднем в 2–4 раза больше, чем в клетках без воздействия СКМП. Авторы объясняют это увеличение содержания цитостатиков-катионов и флуорохромов-катионов в клетках изменением барьерных свойств мембран опухолевых клеток под действием СКМП. Основным барьером для проникновения в клетку заряженной молекулы химиопрепарата является величина электрических параметров поверхности клетки, таких как ее мембранный потенциал и электрический заряд поверхности. Взаимодействие электромагнитного поля и любого проникающего иона с клеткой также определяется ее электрическими характеристиками, основным из них является средний мембранный потенциал, как управляющий параметр [2]. Можно предположить, что одним из биофизических механизмов повышения биодоступности цитостатиков в опухолевые клетки при НРМП является эффективное электромагнитное воздействие, обеспечивающее регуляторную роль мембранного потенциала с учетом его влияния на процессы пролиферации, дифференцировки, миграции, поляризации, частоты деления клеток.
Целью работы на первом этапе явилась проверка в опытах на изолированных клетках in vitro увеличения содержания гемцитабина в удаленной опухоли НРМП при воздействием на нее СКМП. Целью на втором, клиническом этапе исследования, явилось снижение уровня рецидивирования у больных НРМП, подвергнутых воздействию сканирующих магнитных полей в процессе адъювантной ВПХТ.
Материалы и методы исследования
Исследования in vitro проводили на 36 образцах ткани опухоли, полученных после проведения ТУР больным НРМП. В каждом конкретном случае получено добровольное согласие больных на использование ткани в научных исследованиях. Из кусочка опухоли готовили препараты для микроскопирования, методика этого процесса подробно описана в работах [7, 8, 2]. Использовали метод флуоресцентных зондов: клетки прижизненно окрашивали потенциалозависимыми флуорохромами и исследовали под люминесцентным микроскопом «Axio Imager.M2», Zeiss. Микросъемку осуществляли при максимальном увеличении (х1000) цветной цифровой камерой Axio Cam HR. Применяли флуоресцентные потенциалозависимые зонды анион АНС (1 – анилинонафталин-8-сульфонат) и катион ДСМ (4-(n-диметиламиностирил)-1- метилпиридиний). Цитостатики: гемцитабин (концентрация 4 мг/мл). Длина волны возбуждения для АНС была 375 нм, для ДСМ 480 нм, длина волн эмиссии для АНС – 450 нм, а для ДСМ – 520 нм. Конечная концентрация АНС в препарате составляла 40 мкм, ДСМ – 20 мкм. Использовали модуль захвата изображения «MosaiX», выбирали 5 колонок и 5 рядов, получали 25 кадров цифровых изображений. Измерения проводили интерактивно, измеряя в среднем от 200 до 400 клеток опухоли. АНС был поставлен фирмой «Serva», а флуорохром ДСМ был синтезирован в НИИ физической и органической химии при ЮФУ. При микросъемке клеток во всех пробах соблюдали одинаковое разрешение и одну и ту же экспозицию съемки. Данные измерений сохраняли в приложении AxioVision, rel.4.8 в файле, совместимом с Excel (Microsoft Office-2003), которые затем сводили в общие электронные таблицы и обрабатывали в Excel. Яркость клеток суммировали по трем цветовым каналам (RGB). Рассчитывали статистические параметрические показатели: среднее, стандартное отклонение, использовали t-test Стьюдента и непараметрический U-критерий Манна-Уитни для оценки уровня значимости различий. Определяли отношения средних яркостей клеток в исходной среде (без воздействия) к показателям клеток с воздействием: присутствием в среде гемцитабина и гемцитабин плюс омагничивание СКМП. Время инкубация с гемцитобином составляло 30–60 мин.
Клеточную взвесь каждого образца (концентрацию клеточной взвеси в каждом препарате доводили до 7 ± 2∙1000/мкл) опухоли делили на 6 частей, половина из которых витально окрашивали липофильным флуоресцентным зондом катионом ДСМ в концентрации 20 мкМ и инкубировали при температуре 22–25 °С в разных вариантах: 1 – с гемцитабином, 2 – после воздействия на клеточную взвесь гемцитабина СКМП, 3 – без воздействий (фон). Аналогичный алгоритм был применен при витальном окрашивании зондом анионом АНС, в концентрации 40 мкМ. На рис. 1 представлены структурные формулы флуоресцентных зондов, доксорубицина и гемцитабина и потенциалозависимого зонда-катиона ДСМ.
В исследование in vivo включены 60 больных НРМП, которые после ТУР и гистологической верификации уротелиального рака вошли в группу промежуточного риска развития рецидива заболевания. Все пациенты получали адъювантную ВПХТ через уретральный катетер 2000 мг растворенного в 50 мл физиологического раствора гемцитабина (в концентрации 40 мг/мл), одно введение в неделю, всего шесть введений. В основной группе больных (n = 30) одновременно с ВПХТ воздействовали на область проекции мочевого пузыря СКМП индукцией 10 мТл со сканированием частоты сигнала от 1 до 150 Гц, экспозицией 10 минут. Генератором электромагнитного сигнала служил отечественный магнитотерапевтический прибор «Градиент-4М» со встроенной микропроцессорной техникой (ООО Научно-производственная фирма «Пульс», г. Ростов-на-Дону) [4]. Между парными индукторами СКМП устанавливали индуктор, создающий постоянное магнитное поле (ПМП) с магнитной индукцией 20 мТл. После окончания процедуры пациент продолжал экспозицию омагниченного раствора химиопрепарата, лежа на спине, животе, левом и правом боку по 15 минут, всего 60 минут. Каждые три месяца после хирургического лечения проводилось комплексное обследование, включая УЗИ органов брюшной полости и малого таза, цитологическое исследование мочи, при необходимости томограмма органов малого таза и цистоскопию для выявления признаков рецидива и прогрессирования заболевания.
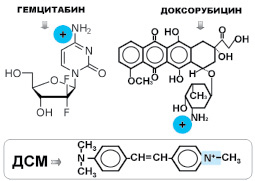
Рис. 1. Структурные формулы используемых зондов-катионов
Результаты исследования и их обсуждение
Изучение флуоресцентной морфологии изолированных живых клеток НРМП и измерение яркостей флуоресценции клеток показало, что гемцитабин изменяет их мембранный потенциал, а именно деполяризует мембрану. Во-первых, следует подтвердить цитотоксическое действие гемцитабина, отмеченное нами в окраске анионом АНС: мертвые клетки ярко окрашивали ядра, и таких клеток было в два раза больше, чем в препарате без гемцитабина. Еще больше, в 5 раз, их было тогда, когда эти клетки были омагничены. Во-вторых: средний мембранный потенциал клеток опухоли с гемцитабином был в 2,2 ± 0,5 раза меньше, чем у интактных клеток. Этот вывод подтверждался при окраске двумя потенциалозависимыми зондами как АНС, так и ДСМ. Данные представлены в таблице. Можно сделать уверенный вывод, что гемцитабин в терапевтической дозе в два раза активнее деполяризует мембраны опухолевых клеток относительно фона в реализации своего цитотоксического эффекта. В отличие от доксорубицина, молекула которого также имеет положительно заряженную группу NH2, как молекула гемцитабина (рис. 1), гемцитабин не является флуорохромом. Поэтому о его повышенном проникновении в клетки опухоли можем судить косвенно. О повышенном его накоплении в опухолевых клетках свидетельствуют аналогичные эксперименты с доксорубицином и ДСМ, описанные в работе [7], в которой показано, что эти катионы под действием СКМП в 2–4 раза более накапливались в клетках опухоли.
Клеточную взвесь мы окрашивали доксорубицином так же как и в работе [8], клетки показаны на рис. 2. Но данные по измерению яркости доксорубицина не вошли в таблицу, поскольку почти все клетки были погибшими при добавлении гемцитабина и действия СКМП.
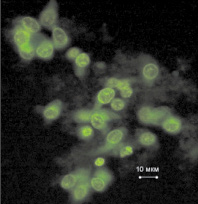
Рис. 2. Клетки рака мочевого пузыря в окраске доксорубицином
В опытных образцах взвеси опухолевых клеток НРМП можно было оценить эффект сочетанного воздействия гемцитабина и СКМП по массовой клеточной деструкции, регистрируемой визуально в полях зрения. На рис. 3 показаны поля зрения с клетками НРМП, окрашенных ДСМ. В них можно видеть зеленую цитоплазму, желто-бурые ядра. Имела место неоднородность клеток по яркости свечения. Сопоставляя показатели средней яркости свечения клеток опухоли, связавших флуорохром-катион ДСМ, можно видеть, что максимальная яркость наблюдаются в исходном состоянии – без воздействия. По сравнению с фоном флуоресценция клеток при добавлении во взвесь гемцитабина уменьшается в 1,8 раз, а при сочетании гемцитабина и СКМП – уменьшается в 2,3 раза. Это свидетельствует о деполяризующем влиянии цитостатика и омагничивания на мембраны опухолевых клеток. Показатели яркости аниона АНС в клетках только подтверждают этот результат, поскольку деполяризация мембраны клеток, окрашенных АНС, сопровождается увеличением яркости. На рис. 3, а и б показаны поля зрения клеток, окрашенных АНС и ДСМ.
Яркость флуоресценции потенциалозависимых флуорохромов, связанных с живыми опухолевыми клетками и доля погибших клеток
|
Флуорохром |
Показатели ± ст.откл. |
Состояние клеточной взвеси |
|||
|
Интактная клеточная взвесь |
Взвесь с гемцитабином |
Клетки сначала омагничены СКМП, затем добавлен гемцитабин |
К взвеси сначала добавлен гемцитабин, затем СКМП |
||
|
АНС |
Вr-яркость, отн. ед. |
306 ± 30* |
670 ± 35* |
706 ± 40 |
800 ± 32 |
|
Доля мертвых клеток, % |
6 ± 4 |
12 ± 6 |
20 ± 5 |
22 ± 6 |
|
|
ДСМ |
Вr-яркость, отн.ед. |
46 ± 6** |
26 ± 4** |
20 ± 3 |
18 ± 5 |
|
Доля мертвых клеток, % |
7 ± 6 |
20 ± 6 |
29 ± 8 |
30 ± 6 |
|
Примечание. Обозначения * и ** – указывают, что различия статистически значимы, p < 0,01.
а 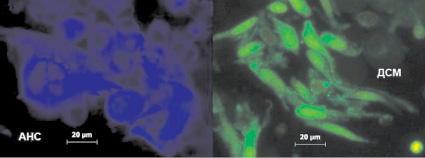 б
б
Рис. 3. Клетки рака мочевого пузыря в окраске АНС и ДСМ
Результаты клинических исследований подтвердили предположение об усилении биодоступности химиопрепарата гемцитабина при адьювантном лечении во время проведения внутрипузырной контактной химиотерапии гемцитабином в сочетании с СКМП. Это выразилось в увеличении безрецидивного периода и уменьшении числа рецидивов в группах сравнения. Так, получено значительное увеличение безрецидивного периода до 17 ± 2 месяцев у 100 % пациентов основной группы, против 6 ± 2 месяцев (р = 0,046), у 15 ± 3 % (р = 0,022) больных в контроле с выявленными рецидивами.
Выводы
Результаты проведенного исследования свидетельствуют о положительном клиническом эффекте применения СКМП в адьювантном лечении ВКХТ больных НРМП. Этот эффект, по-нашему мнению, заключался в увеличенной биодоступности гемцитабина, как заряженной молекуле-катионе, на которую в первую очередь воздействует приложенное электромагнитное воздействие. Опыты in vitro с изолированными клетками опухоли доказали изменение проницаемости мембран клеток при взаимодействии с гемцитабином.

