Отморожения являются важной и далеко не разрешённой проблемой современной медицины в мирное и военное время. Для нашей страны, обширные территории которой расположены в северных широтах, проблема действия низких температур особенно важна. Поэтому в плане изучения механизмов развития криоповреждений большую актуальность приобретает изыскание возможностей регуляции [2, 1] этого патологического процесса.
Цель исследования – рассмотрение тонких механизмов двух программ адаптации: синтоксической и кататоксической [1], которые включаются при повреждении различной интенсивности и приводят к восстановлению гомеостаза (раздражители слабые или средней силы) или энантиостаза (действие сильных раздражителей).
В течение длительного времени мы проводили экспериментально-клиническое изучение эффектов экдизона и его растительных аналогов гормонов линьки и метаморфоза членистоногих на различных уровнях биологической организации млекопитающих, в результате чего показано, что уже нанаграммовых количествах эти соединения вызывают широкий диапазон выраженных фармакологических эффектов. Мы выделяли эти соединения из многих растений семейства гвоздичные, таких как волдырник ягодный (Cucubalus bacciper L.), смолёвки татарской (Silene tatarica L.) и других видов [3].
Установлено, что существует группа веществ, на фоне введения которых действие сильных стрессов (холод, травма и др.) не приводит к повреждениям, характерным для данной патологии. Не отмечается при этом классических симптомов стресса [4]. В указанную группу вошли фертильные факторы и плацентарные белки (α2-микроглобулин фертильности (AMГФ), трофобластический-β1-гликопротеид (ТБГ), плацентарный лактоген человека (ПЛЧ) и др.), спиртовые экстракты из различных насекомых, фитоэкдистероиды и др. [4,5]. Аналогичные свойства проявили фармакологические препараты, блокирующие адренореактивные структуры гипоталямуса (пирроксан, бутироксан и др.) [5]. Блокада адренореактивных структур реципрокно приводит к активации холинореактивных структур гипоталямуса. Возбуждение последних, под влиянием указанных веществ, запускает целый каскад определённых вегетативных реакций, проявляющихся активацией антиоксидантных, антисвертывающих механизмов крови с явлениями иммуносупрессии (вероятно, еще и другими механизмами), что препятствует классическим проявлениям стресса, названые нами синтоксическими программами адаптации. Нашими исследованиями установлено, что важная роль в осуществлении адаптивных реакций принадлежит вентромедиальному ядру гипоталамуса. Выявлена обратная зависимость между активностью вентромедиального ядра гипоталамуса и включением синтоксических программ адаптации [4]. Чем выше стимуляция этой структуры, тем менее активны проявления синтоксических программ адаптации. Напротив, снижение активности вентромедиального ядра гипоталамуса (за счет фармакологической блокады, разрушения или незрелости) приводит к резкой активации синтоксических адаптивных программ. Этим обстоятельством, видимо, и объясняется устойчивость новорожденных животных к действию криотемператур, которое не приводит к развитию отморожения. Отморожение происходит на 8–14 день после рождения, когда созревает вентромедиальное ядро гипоталамуса [4, 5].
Эти явления невозможно объяснить с позиции теории стресса. Синтоксины и кататоксины являются веществами находящимися в организме животных и растений, действие которых направлено на поддержание гомеостаза или энантиостаза. Недостаточное выделение синтоксинов в организме животных (АМГФ, ТБГ и др.) сопровождается соответствующими патологическими процессами (например, развитием плацентарной недостаточности) и введение синтоксинов приводит к нормализации патологического процесса.
Экспериментальные исследования показали, что введение синтоксинов сопровождается активацией синтоксических (активация антиокислительных, противосвертывающих механизмов крови с явлениями иммуносупрессии), а введение кататоксинов приводит к активации кататоксических программ адаптации (депрессия антиоксидантных и противосвертывающих механизмов крови с явлениями иммуноактивации).
Материалы и методы исследования
Для изучения степени включения синтоксических и кататоксических программ адаптации при нанесении криотравмы были проведены эксперименты на 160 крысах, а также клинические наблюдения за 120 больными с отморожениями II–IV степени. Криотравма сильной интенсивности вызвалась распылением хлорэтила на тазовые лапки крыс до снижения температуры стоп –7,4 ± 0,06 °С с развитием отморожения 3,5 ± 0,01 степени и мутиляцией тканей на 5-6 сутки наблюдения. У всех животных в разные сроки после согревания (20 мин, 2 и 4 ч, 1, 2, 5 и 10 суток) в крови, оттекающей из зоны криотравмы, исследовали состояние антиоксидантного, противосвертывающего и иммунного потенциалов крови, а также обмен биологически активных аминов по общепринятым методикам на биохимическом анализаторе FP-901 фирмы «Labsistems Boehringer» с использованием реактивов фирмы «Mannheim». У животных также исследовали артериальное давление и записывали электрокардиограмму во II стандартном отведении.
Коэффициент активности синтоксических программ адаптации (КАСПА) рассчитывали следующим образом:
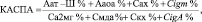
где Аат-Ш – активность антитромбина III в %; Ааоа – общая антиокислительная активность плазмы в %; Сах – концентрация ацетилхолина в крови в нмоль/л; Cigm – концентрация иммуноглобулина М в крови; Са2мг – концентрация α2-макроглобулина в мкмоль/л; Смда – концентрация малонового диальдегида в мкмоль/л; Скх – концентрация катехоламинов в мкг/л; CigA – концентрация иммуноглобулинов А в мкмоль/л.
Результаты исследования и их обсуждение
Результаты исследований показали, что сильная криотравма проявляется фазовыми изменениями артериального давления с изменением чувствительности сосудистой стенки к прессорным и депрессорным аминам. В начале действия раздражителя отмечается повышение артериального давления с последующим снижением его со 100,0 ± 0,9 до 75,0 ± 1,8 мм рт.ст. и повышением реактивности сосудистой стенки к экзогенно вводимым медиаторам нервной системы в первые минуты после согревания с дальнейшим снижением реактивности и уменьшением артериального давления, характерного для шоковой реакции. В момент нанесения сильной криотравмы отмечалась активация адренергических структур мозга с одновременной депрессией холинергических структур, показателем которого является снижение концентрации норадреналина в структурах подбугорья с 0,59 ± 0,02 до 0,36 ± 0,01 нмоль/г и увеличением концентрации ацетилхолина с 8,6 ± 0,16 до 9,5 ± 0,14 нмоль/г с противоположными сдвигами в циркулирующей крови.
Возникающая депрессия холинреактивных и активация адренореактивных механизмов подбугорья способствует включению кататоксических программ адаптации с переходом на новое функциональное состояние, направленное на защиту от поступления в общую циркуляцию токсических веществ. Повышение концентрации катехоламинов в крови сопровождается различного рода альтерационными процессами на мембранах, особенно при активации перекисного окисления липидов, проявляющееся увеличением концентрации гидроперекисей липидов с 1,3 ± 0,07 до 2,3 ± 0,09 ОЕ/мл, малонового диальдегида с 0,65 ± 0,06 до 1,21 ± 0,07 мкмоль/л с угнетением общей антиокислительной активности с 25,5 ± 1,4 до 12,8 ± 1,04 % и каталазы. Возникающее угнетение холинэргических и антиокислительных систем сопровождается депрессией антисвертывающих механизмов крови, перестройкой гемокоагуляционной системы на локальное тромбообразование за счет повышения активности адренореактивных структур мозга, сопровождаясь спазмом сосудов в зоне криотравмы и последующим их тромбозом. На депрессию противосвертывающих механизмов крови указывало снижение концентрации гепарина с 0,50 ± 0,03 до 0,23 ± 0,02 Е/мл, антитромбина III с 90,5 ± 1,36 до 55,0 ± 2,23 и плазмина с 11,0 ± 0,65 до 2,7 + 0,42 мм2, при этом, такой интегративный показатель, как КАСПА, в процессе развития холодовой травмы снижался с 1,03 ± 0,01 до 0,30 ± 0,01 через 4 часа после согревания и до 0,21 ± 0,01 через 1 сутки, возвращаясь к исходным величинам после мутиляции конечностей до 0,93 + 0,02. Данный показатель указывает на доминирование кататоксических программ адаптации с реципрокным снижением синтоксических.
Время свертывания крови при нанесении сильной холодовой криотравмы снижалось с 135,5 ± 5,41 до 58,8 ± 3,62 с через 1 сутки. Наряду с потреблением факторов противосвертывающей системы крови отмечалось и потребление тромбоцитов. Их концентрация уменьшилась с 468,3 ± 6,1∙109 до 380,0 ± 5,77∙109/л с резким возрастанием их адгезивности с 19,0 ± 0,89 до 49,0 ± 3,63 %. На торможение фибринолиза указывало повышение концентрации антиплазминов (α2-макроглобулина с 3,8 ± 0,11 до 6,3 ± 0,19 мкмоль/л и α1-антитрипсина с 36,6 ± 1,45 до 60,0 ± 1,76 мкмоль/л). Предварительное введение фитоэкди- стероидов, активирующих синтоксические программы адаптации, способствовало снижению тяжести некротических расстройств за счет повышения активности антиоксидантных и противосвертывающих механизмов крови.
Сильная криотравма выявляла стационарное состояние энантиостатических механизмов, которые характеризуются депрессией холинореактивных, антиоксидантных и противосвертывающих механизмов крови, приводящих к нарушению кровообращения в зоне криотравмы с последующим удалением криоповрежденных тканей. На возникающие некротические процессы в зоне криовоздействия указывала и повышенная активность сывороточных ферментов. Активность лактатдегидрогеназы возрастала с 560,0 ± 20,5 до 1060,0 ± 66,9 Е/л и креатинфосфокиназы – с 1110,0 ± 87,6 до 3240,0 ± 305,4 Е/л.
Криотравма у больных площадью более 5 % в реактивный период сопровождалась включением кататоксических программ адаптации с активацией адренореактивных структур мозга, депрессией холинореактивных, антиоксидантных и противосвертывающих механизмов крови с явлениями активации иммуногенеза. Возрастало количество Т-лимфоцитов (CD3+) с 1,37 ± 0,14 до 2,73 ± 0,10∙109/л и увеличивалась концентрация лимфоцитов (CD20+) с 0,18 ± 0,01 до 0,52 ± 0,01∙109/л. Резко возрастала концентрация естественных киллеров (CD16+) с 0,27 ± 0,02 до 0,76 ± 0,04∙109/л с одновременным снижением концентрации Т-супрессоров (CD8+) с 0,53 ± 0,01 до 0,26 ± 0,01∙109/л и увеличением концентрации Т-хелперов (CD4+) с 0,39 ± 0,02 до 1,14 ± 0,01∙109/л, что отражалось на выработке иммуноглобулинов G и А и состоянии неспецифической иммунной резистентности (увеличение процесса фагоцитоза, индекса стимуляции, НСТ- и ЛКБ-тестов). Повреждение криоохлажденных тканей иммунной системой сказывалось и на изменении активности сывороточных ферментов, таких как ЛДГ и КК. ЛДГ в реактивный период возросла с 410,1 ± 20,7 до 870,0 ± 45,6 Е/л и КК с 130,0 ± 14,4 до 990 ± 42,2 Е/л.
Выводы
Таким образом, включение кататоксических программ адаптации направлено, прежде всего, на удаление тканей, подвергшихся криовоздействию. Активация синтоксических программ адаптации направлена на сопереживание с холодовым раздражителем и, как следствие, на торможение некротических расстройств.

