В последние годы большое внимание исследователей и практикующих специалистов привлекают вопросы своевременной диагностики и эффективного лечения папилломавирусной инфекции (ПВИ) человека, что связано с неуклонным ростом ее распространенности, высокой контагиозностью и доказанной онкогенностью [9, 10]. Вирус папилломы человека (ВПЧ) обусловливает многообразие поражений кожи и слизистых оболочек. Полагают, что папилломавирусная инфекция носит оппортунистический характер, и манифестация болезни происходит на фоне изменений в иммунной системе, которая становится несостоятельной в распознавании и элиминации трансформированных вирусом клеток [1, 2, 5, 9]. В то же время, несмотря на широкое распространение инфекции и большое количество посвященных ей исследований, до настоящего времени мало изучены факторы, лежащие в основе рецидивирования ПВИ [6, 7].
Вирус папилломы человека широко распространен в популяции. У мужчин, как и у женщин, доминирующим кофактором, способствующим развитию ВПЧ-инфекции, является сексуальная активность. В целом, рак гениталий, как и выявление ВПЧ, регистрируется чаще среди пациентов, рано начавших половую жизнь и имеющих большое количество половых партнеров [2, 3, 4]. Так, высок процент обнаружения этого вируса у сексуально активных подростков и молодых людей, не использующих барьерные методы контрацепции. Вторым важнейшим кофактором инфицирования, снижающим местный иммунитет является урогенитальная инфекция: хламидии, уреаплазмы, микоплазмы и условно-патогенная микрофлора [8]. Данные о частоте ПВИ урогенитального тракта в России недостаточно полны и основаны на статистике отдельных медицинских учреждений или врачей, занимающихся этой патологией [10]. Диагностика ПВИ представляет определенные трудности, особенно ее латентной формы, при которой, несмотря на наличие вируса папилломы человека (ВПЧ), морфологических изменений в ткани не наблюдается [9].
Отягчающим фактором является длительная персистенция ВПЧ, на фоне которой развивается интраэпителиальная неоплазия, в 15,0 – 20,0 % случаев приводящая к carcinoma in situ и инвазивному раку [4, 6, 7]. Потенциальный риск озлокачествления эпителия при длительно существующей (персистирующей) папилломавирусной инфекции диктует необходимость обязательной санации при выявлении ВПЧ.
Материалы и методы исследований
На базе Уральского НИИ дерматовенерологии и иммунопатологии было проведено комплексное клинико-лабораторное обследование 360 мужчин в возрасте от 21 до 46 лет (средний возраст составил 33,2 ± 2,2), обратившихся с различными жалобами со стороны органов мочеполового тракта. Из всех обследованных пациентов 54,0 % имели половые контакты с одной половой партнершей, 32,0 % имели половые контакты с двумя половыми партнершами и 14,0 % мужчин – с тремя и более половыми партнершами. Клиническое обследование включало осмотр наружных половых органов, ректальное пальцевое исследование предстательной железы. Материалом для бактериоскопического и бактериологического исследования служило отделяемое уретры. Исследование проводилось в нативных препаратах и при микроскопии препаратов, окрашенных метиленовым синим и по Грамму. Исследование урогенитальной микрофлоры выполнялось в соответствии с методическими указаниями по применению унифицированных микробиологических (бактериологических) методов исследования в клинико-диагностических лабораториях утвержденными приказом Минздрава СССР № 535 от 22 апреля 1985 г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Идентификацию выделенных дрожжеподобных грибов проводили на среде Candiselect, для определения чувствительности к антимикотикам использовали фунгитест Bio-RAD (Франция). Для идентификации U.urealyticum и M.hominis был использован культуральный метод исследования, с использованием набора Mycoplazma IST 2 фирмы Bio-Meriux (Франция) с подсчетом колониеобразующих единиц и определением чувствительности к антимикробным препаратам. Полимеразная цепная реакция использовалась для выявления C. trachomatis, M. genitalium, Cytomegalovirus, Herpes simplex I и II типов и Human Papillomavirus 16/18, 31/33, 35/45 типов.
Результаты исследования и их обсуждение
При первичном обращении основными жалобами пациентов были дискомфорт в мочеиспускательном канале (61,0 %), дискомфорт в области промежности (18,0 %), выделения из уретры слизистого или слизисто-гнойного характера (30,0 %), жжение в уретре (43,0 %), гиперемия и отечность губок уретры (54,0 %), гиперемия кожи головки полового члена (36,0 %), налет на головке полового члена (22,0 %). Высыпания на половом члене в виде остроконечных кондилом наблюдались у 50 (14,0 %) пациентов (табл. 1).
Таблица 1
Жалобы больных с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией
|
Жалобы больных |
Число пациентов |
|
|
Абс. |
% |
|
|
Выделения из уретры |
108 |
30,0 |
|
Дискомфорт в уретре |
219 |
61,0 |
|
Жжение в уретре |
155 |
43,0 |
|
Гиперемия и отечность губок уретры |
194 |
54,0 |
|
Налет на головке полового члена |
79 |
22,0 |
|
Гиперемия кожи головки полового члена |
129 |
36,0 |
|
Наличие остроконечных кондилом |
50 |
14,0 |
|
Дискомфорт в области промежности |
65 |
18,0 |
Результаты обследования пациентов на ВПЧ высокого онкогенного риска показали высокий уровень инфицированности мужчин, обратившихся на прием. ВПЧ был выявлен у 86 (24,0 %) пациентов. Сравнительный анализ частоты встречаемости различных генотипов ВПЧ показал, что наиболее часто выявлялся 16 тип ВПЧ (33,7 %), 18 тип определялся у 8,1 % больных, 31 тип – у 4,6 %, 33 тип – у 3,5 %, 35 тип – у 4,6 %, 45 тип – у 2,3 %. У целого ряда пациентов было выявлено микстинфицирование различными генотипами ВПЧ. Так у 18 (20,9 %) больных было выявлено два генотипа ВПЧ, у 15 (17,4 %) пациентов – три генотипа, а у 4 (4,6 %) мухчин – четыре генотипа ВПЧ (табл. 2).
Таблица 2
Удельный вес частоты встречаемости различных серотипов ВПЧ у пациентов с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией
|
Серотипы ВПЧ |
Число пациентов (n = 86 чел.) |
|
|
Абс. |
% |
|
|
16 |
29 |
33,7 |
|
18 |
7 |
8,1 |
|
31 |
4 |
4,6 |
|
33 |
3 |
3,5 |
|
35 |
4 |
4,6 |
|
45 |
2 |
2,3 |
|
Два серотипа |
18 |
20,9 |
|
Три серотипа |
15 |
17,4 |
|
Четыре серотипа |
4 |
4,6 |
Микстинфицирование различными генотипами ВПЧ обеспечивает менее благоприятный прогноз течения заболевания и терапии. Было установлено, что микстинфицирование несколькими генотипами ВПЧ достоверно коррелирует с характером течения ПВИ. При персистирующем течении ПВИ микстинфицирование регистрируется чаще. Сочетание различных генотипов ВПЧ высокого канцерогенного риска (16/18 тип) и потенциально канцерогенных способствует персистенции ПВИ. Генотипирование дает возможность дифференцирования персистирующей инфекции от новоприобретенной. Микстинфицирование генотипами ВПЧ снижает скорость элиминации вируса из организма и является неблагоприятным прогностическим признаком.
Анализ заболеваемости другими ИППП показал, что частота смешанных ИППП доминировала над моноинфекцией. При проведении диагностики методом ПЦР было выявлено сочетание ВПЧ с другими инфекциями передающимися половым путем. Так у 6 (7,1 %) пациентов было обнаружено наличие Ch. trachomatis, у 25 (29,2 %) – U. urealyticum, у 9 (10,0 %) – M. genitalium (табл. 3).
Таблица 3
Частота сопутствующих урогенитальных инфекций у мужчин с ВПЧ-инфекцией
|
Возбудители |
Число пациентов |
|
|
Абс. |
% |
|
|
Ch. trachomatis |
6 |
7,1 |
|
U. urealyticum |
25 |
29,2 |
|
M. genitalium |
9 |
10,0 |
|
Условно-патогенная микрофлора |
56 |
65,1 |
Как известно, сопутствующие инфекции, передаваемые половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов. При смешанной инфекции не исключается возможность синергического действия на развитие и течение воспалительного процесса.
При бактериологическом исследовании отделяемого уретры больных с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией наиболее часто обнаруживался Enterococcus faecalis (22,0 %), у 15,0 % больных был выделен Streptococcus agalactiae, у 11,0 % – E.coli, у 4, 0 % – Staphilococcus aureus, у 4,0 % – Haemophilus parainfluenzae, у 3,0 % – Candida albicans, у 3,0 % – Gardnerella vaginalis (рис. 1).
Обследование на онкогенные типы ВПЧ показано пациентам с ИППП, нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. По эпидемиологическим показаниям обследованию на онкогенные типы ВПЧ подлежат половые партнеры женщин с ИППП, в том числе вирусной этиологии, пациенты с ранним возрастом начала половой жизни, лица промискуитетного поведения.
Латентная форма ПВИ диагностируется только с помощью молекулярно-биологических методов исследования – выявление ВПЧ высокого онкогенного риска методом ПЦР при отсутствии клинических проявлений. Далее осуществляется определение онкогенного генотипа ВПЧ в урогенитальном тракте, сочетанного инфицирования ВПЧ различных генотипов.
Производится комплексное бактериологическое, бактериоскопическое, молекулярно-биологическое (ПЦР) исследование отделяемого уретры на N.gonorrhoeae, T.vaginalis, C.trachomatis, U.urealyticum, M.hominis, M.genitalium, G.vaginalis, дрожжеподобные грибы рода Candida, Herpes simplex virus I,II типов, Cytomegalovirus, определение микрофлоры урогенитального тракта с учетом количества, вида микроорганизмов и чувствительности микрофлоры к антибиотикам, выявление микстинфицирования ИППП. При верификации сопутствующих ИППП и условно-патогенной микрофлоры в диагностически значимых титрах лечение пациенту назначается в соответствии с чувствительностью к антибиотикам. Сопутствующие ВПЧ инфекции, передающиеся половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов.
На втором этапе – определение варианта течения папилломавирусной инфекции (транзиторный, персистирующий). Критериями персистирующего течения считаются случаи трехкратного и более выделения ВПЧ высокого онкогенного риска (16/18 генотипов) в соскобах из уретры методом ПЦР при взятии материала с интервалом в 3–6 месяцев. Критерии транзиторного течения ПВИ: инфицирование ВПЧ высокого онкогенного риска эпителиальных клеток уретры в течение 3–6 месяцев, когда вирус папилломы человека выявлялся однократно, с последующими отрицательными результатами исследований.
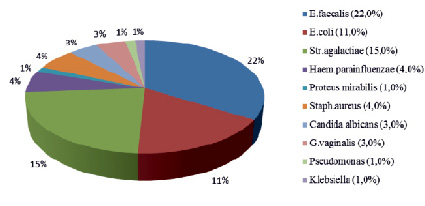
Рис. 1. Анализ структуры условно-патогенной микрофлоры при вирусно-бактериальных уретритах
При транзиторном варианте течения папилломавирусной инфекции урогенитального тракта, при отсутствии манифестных проявлений, необходимо диспансерное наблюдение в кожно-венерологическом учреждении с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной ПВИ рекомендовано назначение противовирусной и/или иммунотропной терапии, способствующее уменьшению степени риска развития неопластических процессов. При латентном течении ПВИ необходимо наблюдение и регулярное обследование в кожно-венерологических учреждениях (рис. 2).
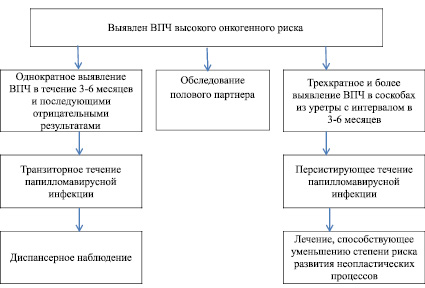
Рис. 2. Алгоритм тактики ведения пациентов с урогенитальной папилломавирусной инфекцией в зависимости от варианта течения
Выводы
Таким образом, проведя анализ полученных данных, можно сделать вывод о высоком уровне инфицированности мужчин репродуктивного возраста ВПЧ высокого онкогенного риска (24,0 %). Клиническими показаниями для обследования на онкогенные типы ВПЧ являются пациенты с инфекциями, передающимися половым путем, нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. При транзиторном варианте течения ВПЧ, при отсутствии манифестных проявлений необходимо диспансерное наблюдение в кожно-венерологических учреждениях с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной папиллома-вирусной инфекции рекомендовано назначение противовирусной и/или иммунотропной терапии.

