Целью работы было изучение возможного механизма превращения оксигенатов на церий- и медьсодержащих катализаторах при умеренных температурах и атмосферном давлении. Согласно литературным данным известно превращение диоксида углерода в метиловый спирт на двухслойном катализаторе СuО + Сu2О в виде наностержней в [4]. При этом, если поместить эти стержни в воду, насыщенную СО2, а затем облучить их солнечным светом, то начинается фотохимическая реакция, которая ведет к выбросу метанола. Способ демонстрирует 95 %-ную эффективность преобразования СО2 в метанол без значительных затрат энергии. Однако не совсем понятен механизм протекающих при этом реакций.
Цель исследования
Для исследования механизма реакций превращения оксигенатов в присутствии водорода были испытаны гетерогенные катализаторы, полученные методом пропитки носителей: ɣ-Al2O3, силикагеля и синтетического цеолита типа NaX растворами азотнокислой и уксуснокислой меди (II) и азотнокислого церия (III) с последующей сушкой, выпариванием и прокаливанием полученного катализатора по классической технологии. В качестве испытуемых модельных оксигенатов были выбраны диоксид углерода и метиловый спирт.
Испытание катализаторов проводили на лабораторной установке, схема которой представлена в работах [1,2]. Испытания проводили в присутствии водорода при мольном соотношении Н2 : оксигенат = (1-3):1.
Результаты исследования и их обсуждение
Результаты представлены на рис. 1 и 2. Основным продуктом реакции является синтез-газ – смесь СО и Н2 в соотношении (1–3):1, а также небольшие количества метана и воды.
По полученным данным видно, что на всех катализаторах достигается высокая конверсия СО2 с образованием СО при достаточно высокой селективности. На цериевом катализаторе достигается практически 100 %-ная селективность, что указано в предыдущих работах [1, 2]. На катализаторе содержащем 3 % Сu на ɣ-Al2O3 при температурах от 250 до 350 ºС достигается 80–90 %-ная конверсия СО2. Продуктом реакции является газовая смесь, содержащая 90 % масс. СО и 10 % СО2 в смеси с водородом. Объемное cоотношение в смеси оксида углерода к водороду составляло 1:(2–3), согласно условиям опытов по начальным расходам газов. Данное соотношение является практически значимым для использования полученного синтез-газа в промышленном процессе синтеза метилового спирта. После выгрузки катализатора из реактора визуально установлено изменение его цвета. Если перед загрузкой катализатор был окрашен в черный цвет, характерный для тенорита (СuО) то после выгрузки цвет катализатора перешел в красно-кирпичный, что характерно для куприта (Сu2О). Аналогично изменяется и цвет цериевого катализатора со светло-желтого, характерного для СеО2 на бесцветный, характерный для Се2О3. Исходя из данного факта можно заключить, что активными фазами катализаторов являются оксиды Сu (I), и Се (III), образование которых может быть результатом частичного восстановления оксидов Сu (II) и Се (IV) водородом на поверхности катализатора при повышенной температуре (180–200 ºС). В процессе опытов наблюдалось выделение воды, наибольшее в начальной стадии.
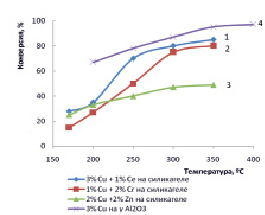
Рис. 1. Зависимость конверсии диоксида углерода от температуры на модифицированных медных катализаторах
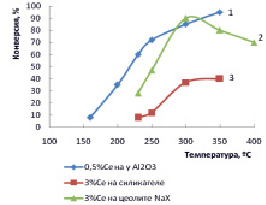
Рис. 2. Зависимость конверсии диоксида углерода от температуры на цериевых катализаторах
Таким образом, превращение диоксида углерода в монооксид в присутствии водорода на церий- и медьсодержащих катализаторах можно объяснить изменением валентности металлов, которая протекает как за счет частичного восстановления высших оксидов металлов водородом и обратно за счет акцепции кислорода восстановленным металлом в низшей валентности. В присутствии водорода данный процесс становится непрерывным.
Ниже представлен возможный механизм реакций, протекающих на поверхности катализаторов:
1. На медьсодержащих катализаторах:
а) 2СuО + Н2 → Си2О + Н2О
б) Сu2О + СО2 →2СиО + СО и далее вновь -
в) 2СиО + Н2 → Си2О + Н2О
2. На церийсодержащих катализаторах:
а) 2СеО2 + Н2 → Се2О3 + Н2О
б) Се2О3 + СО2 → 2СеО2 + СО и далее вновь -
в) 2СеО2 + Н2 → Се2О3 + Н2О
Изменение валентности церия с высшей на низшую и обратно описано также в работе [3, 5]. В частности указано, что при высоких температурах Се (IV) изменяет свою валентность, приобретая при этом акцепторные свойства к кислороду, содержащемуся в диоксиде углерода [3].
Аналогичные опыты были проведены нами на цериевом катализаторе с использованием метилового спирта в качестве оксигената. Результаты экспериментов на катализаторе содержащем 5 % Се на ɣ-оксиде алюминия показали, что основными продуктами реакции являются монооксид углерода и метан (таблица), то есть для метилового спирта подтверждается акцепторный механизм удаления кислорода:
а) 2СеО2 + Н2 → Се2О3 + Н2О
б) Се2О3 + СН3ОН → СН4 + 2СеО2
И далее вновь повторяется первая реакция частичного восстановления Се (IV) в Се (III). Мольное соотношение СО:СН4 в продуктах реакции близко к стехиометрическому по реакции – 1,75, что также подтверждает акцепторный механизм удаления кислорода из молекулы оксигената.
Гидроконверсия метилового спирта на катализаторе Се/ɣ-Al2О3
|
Т, ºС V, ч-1 |
VМеОН ч-1 |
V Н2, мл/мин |
Состав, % масс. |
СО:СН4 |
||
|
СО |
СН4 |
СО2 |
||||
|
200 |
0,15 |
300 |
66,3 |
32,0 |
1,2 |
2,07 |
|
210 |
0,3 |
300 |
63,1 |
32,0 |
4,9 |
1,97 |
|
250 |
0,3 |
300 |
60,5 |
35,5 |
4,0 |
1,70 |
|
270 |
0,3 |
300 |
59,5 |
34,0 |
6,5 |
1,75 |
|
300 |
0,3 |
300 |
60,2 |
34,4 |
5,4 |
1,75 |
При гидроконверсии метанола кроме основных компонентов метана и монооксида углерода образуется небольшое количество диоксида углерода до 6 %. Образование диоксида углерода, вероятно, является результатом вторичной реакции образовавшегося монооксида углерода с оксидом церия четырехвалентного на поверхности катализатора. Монооксид углерода является активным восстанавливающим агентом и способствует превращению остаточного количества оксида церия четырехвалентного в оксид церия трехвалентного и одновременно увеличивает число активных центров. Очевидно, этим фактом объясняются и высокая активность и селективность превращения оксигенатов на церийсодержащем катализаторе, в частности превращение диоксида углерода в монооксид углерода со 100 %-ной селективностью и 99 %-ной конверсией. Этим же можно объяснить и отсутствие отложений углерода (кокса) на поверхности катализатора, так как глубокого полного восстановления диоксида углерода в углерод не происходит, что обеспечивает длительный срок службы катализатора без снижения активности:
2СеО2 + СО → СО2 + 2Се2О3
Очевидно, что подобная реакция может протекать на медьсодержащем катализаторе:
2СuО + СО → СО2 + Сu2О
Выводы
Таким образом, показана возможность получения синтез – газа гидроконверсией диоксида углерода при умеренных температурах и атмосферном давлении на церий и медьсодержащих катализаторах. Предложен возможный механизм реакции за счет акцепторных свойств по отношению к кислороду в оксигенатах одновалентной меди и трехвалентного церия, образующихся на поверхности катализатора в присутствии водорода.

