Рак легкого чаще диагностируется в старших возрастных категориях – 50–80 лет, в то время как в более молодой популяции он встречается всего в 9–14 % случаев. Ряд авторов отмечает рост заболеваемости раком легкого [5, 6], при этом заболеваемость обычно ассоциируется с экологическими факторами и курением [7].
Магнитно-резонансная томография (МРТ) грудной клетки в настоящее время используется в большей степени для исследований головного и спинного мозга, позвоночника и суставов, большинства внутренних органов, реже – сердца и сосудов с контрастным усилением, где она является наиболее чувствительным и специфичным методом выявления, как ишемических, так и не ишемических повреждений миокарда.
Для диагностики легочных заболеваний «золотым стандартом» по-прежнему считается спиральная рентгеновская компьютерная томография (СРКТ) с внутривенным контрастным усилением, которая при большинстве патологических состояний легкого позволяет их выявить и дифференцировать с показателями чувствительности и специфичности более 90 %. Менее значимо использование обычных рентгеновских и цифровых снимков (50 %), а так же ультразвука (15–20 %) [1]. Однако развитие магнитно-резонансной томографии (МРТ), создание возможностей получения МР-томографических срезов синхронно с физиологическими сигналами дыхания и сердечного ритма, также позволяют получать изображения легких с высоким пространственным разрешением. Важнейшим преимуществом исследований легких методами МРТ является полное отсутствие лучевой нагрузки и возможность использования контрастного усиления парамагнетиками. Парадоксальным образом метод контрастированной МРТ легких в достаточной мере не развит, хотя первые попытки получения МР-изображения легких, в т. ч. нами, уже предпринимались [2, 3, 4]. Однако из-за отсутствия синхронизации с дыханием, длительности исследования широкого распространения МРТ легких на низкопольных томографах не получила. Вместе с тем, при исследовании сердца в ЭКГ-синхронизированном режиме, даже на низкопольном томографе удавалось оценить состояние лимфатических узлов средостения и распространенности рака легкого при МРТ в случаях его рецидивов [5].
В настоящей работе мы попытались оптимизировать методику МРТ легких с контрастным усилением, благодаря режимам записи изображений в условиях синхронизации с дыханием и ЭКГ. В настоящий момент используем её при необходимости у пациентов с патологией органов грудной клетки в диагностике и оценке распространенности рака легкого, в т. ч. в динамике противоопухолевой комплексной терапии.
Цель настоящей работы – оценить возможности низкопольной и высокопольной магнитно-резонансной томографии с использованием внутривенного контрастирования в диагностике распространенности рака легкого.
Материал и методы исследования
МРТ грудной клетки с синхронизацией по дыханию была выполнена с контрастным усилением у 20 пациентов (19 мужчин и 1 женжина в возрасте 48 ± 6 лет), у которых по данным комплексного обследования было верифицировано наличие центрального (у 13 больных) или периферического (у 7 больных) РЛ. По 3 пациента из каждой группы были прооперированы с выполнением расширенной пульмонэктомии, тогда как у остальных больных в связи с неоперабельностью осуществлялось комплексное химиолучевое лечение. Исследования проводились в сравнении с результатами исследований контрольной группы – 15 пациентов с ишемической болезнью сердца и перенесенным острым инфарктом миокарда, которым исследование грудной клетки с парамагнитным контрастированием выполнялось по кардиологическим показаниям.
МРТ с контрастным усилением была выполнена с полным охватом области грудной клетки, плечевого пояса, нижних отделов области шеи, а также верхнего этажа брюшной полости. Контрастирование парамагнетиком с внутривенным введением осуществлялось в дозе 0,1 ммоль на 1 кг массы тела. До введения контраста и спустя 12–15 мин после введения, были записаны Т1-взвешенные синхронизированные по дыханию на момент выдоха спин-эхо изображения при TR = 450–700 мс, TE = 15–20 мс, в матрицу 256×256 пикселей, при размере области исследования до 400×380 мм и толщине среза 7–8 мм (МР-томографы: Магнетом-Опен /Siemens Medical/ и Тошиба Титан Вантаж /Toshiba Medical/). Анализ изображений осуществлялся визуально 2-я независимыми рентгенологами, не информированными о деталях клинической картины пациента; при этом оценивалась как исходная анатомическая картина, так и интенсивность аккумуляции контраста. Оценка поглощения выполнялась качественно, кроме того, рассчитывался количественный индекс усиления (ИУ) Т1-взвещенного спин-эхо изображения, как:
ИУ = (интенсивность Т1-взв. МРТ)контраст. / / (интенсивность Т1-взв. МРТ)исходн.
Проводились также исследования по протоколам Т2-спин-эхо взвешивания, и диффузионно-взвешенные исследования грудной клетки и брюшной полости (b = 600–800). Статистическая обработка результатов была проведена с использованием непараметрических критериев (Манна-Уитни, Вилкоксона). Достоверность различий считалась значимой при р < 0,05.
Результаты исследования и их обсуждение
Проведение МРТ грудной клетки с контрастным усилением (рис. 1, А, Б, В) позволило уверенно визуализировать опухолевые поражения лимфоузлов при из размере более 1 см за счет интенсивной аккумуляции контрастного препарата в толще опухоли, а также первичные опухолевые новообразования при их размерах более 1,5 см.
Интенсивное накопление контраста-парамагнетика было отмечено в периферических отделах опухоли, тогда как центральные отделы оставались практически неизменными (таблица).
У пациентов с неоперабельным раком лёгкого прогноз жизни после проведения комплексного химиолучевого лечения зависел от снижения показателей ИУ: в случае уменьшения его на 50 % и более по сравнению с исходным значением до начала лечения средняя продолжительность жизни составила 10,8 ± 1,2 мес. (рис. 2), тогда как при отсутствии снижения ИУ или снижении на 10–45 % продолжительность была лишь 6,7 ± 1,1 мес. Поэтому в ближайшей перспективе обоснованно рассматривать контрастированную МРТ легких в качестве общедоступного метода контроля эффективности комплексной противоопухолевой терапии рака легкого [4, 8], тем более что это исследование не сопровождается по своим физическим принципам лучевой нагрузкой.
Визуализация опухолевых поражений легких у с злокачественными новообразованиями используется достаточно давно, однако в значительных по объему опубликованных данных – без использования парамагнитного контрастирования [2, 4, 11]. Это ограничивает получаемую информацию анатомическими данными, в то время как важнейшая особенность злокачественного новообразования – патологический характер васкуляризации – остается невизуализированным. Кроме того, в анатомической визуализации процесса более высокое пространственное разрешение рентгеновских томографических методов создает им объективные преимущества [1, 4, 8]. В свою очередь парамагнитное контрастирование при МРТ позволяет эффективно и безвредно для пациента визуализировать именно характер патологической васкуляризации злокачественных новообразований. Поэтому мы у всех пациентов, обследуемых рутинно, используем парамагнитное контрастирование.
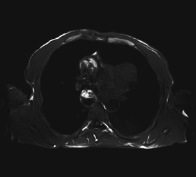 А
А 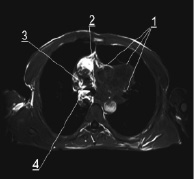 Б
Б
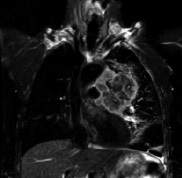 В
В
Рис. 1. Типичная картина МР-томографической визуализации распространенного опухолевого поражения – центрального рака левого легкого с контрастным усилением. А – Т1-взвешенное исходное спин-эхо изображение аксиального среза грудной клетки на уровне D4-D5. Б – Т1-взвешенное спин-эхо изображение на том же уровне после парамагнитного внутривенного контрастного усиления. Визуализируется на фоне остаточного внутрисосудистого пула контраста в просвете аорты накопление парамагнетика в периферических отделах первичной опухоли центрального рака левого легкого (1), пораженных медиастинальных лимфоузлах (2), пораженном корне правого легкого (3) и опухолевого тромбоза верхней полой вены (4). В – фронтальный Т2-взвешенный срез грудной клетки – на максимуме накопления
Показатели усиления интенсивности Т1-взвешенного спин-эхо изображения МРТ после парамагнитного контрастирования (для различных патологических структур) при раке легкого
|
Анатомическая область |
Индекс усиления |
|
Периферические отделы опухоли |
2,41 ± 0,32; p < 0,002 |
|
Центральный отделы опухоли |
1,18 ± 0,09; p < 0,05 |
|
Пораженные лимфоузлы корня ипсилатерального легкого |
2,26 ± 0,31; p < 0,005 |
|
Пораженные лимфоузлы корня контралатерального легкого |
1,64 ± 0,24; p < 0,01 |
|
Очаги бронхогенной диссеминации |
1,52 ± 0,18; p < 0,02 |
Примечание: Достоверность различия p – по сравнению с контрольной группой.
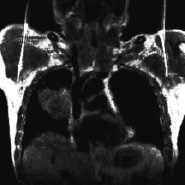 а
а 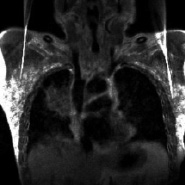 б
б
Рис. 2. МРТ легких с контрастным усилением у пациента при впервые выявленном центральном раке правого легкого (а) и после эффективной терапии цисплатином (б). Достоверное уменьшение размеров новообразования (исходно – 49×51×46 мм, после терапии – 42×44×35 мм) и индекса усиления при контрастировании парамагнетиком (исходно ИУ = 1,54, после терапии – 1,15). Пациент скончался спустя 13,5 мес. после постановки диагноза рака легкого вследствие обширного острого геморрагического инсульта. Стрелками показан опухолевый узел и его уменьшение в динамике
Как при визуальном, так и при количественном анализе оказалось, что использование парамагнетиков обеспечивает выраженное усиление интенсивности изображения именно злокачественного новообразования легкого и метастазов более чем на 40 % в хорошо кровоснабжаемых, т.е. васкуляризированных – периферических отделах опухоли (таблица). Возможно и использование МРТ на более поздних стадиях для оценки распространенности процесса и выявления осложнений (рис. 3), когда применение рентгеноконтрастных препаратов нежелательно.
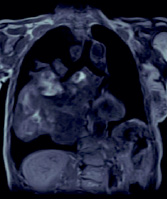 а
а 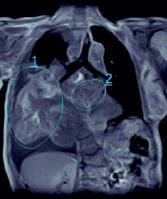 б
б
Рис. 3. Картина участков распада правого легкого и распространенной аккумуляции контраста-парамагнетика в толще первичной опухоли у пациентки (75 лет) с обширным центральным раком правого легкого (обозначено маркером 1 на рис. б) и также в области обширного метастатического поражения медиастинальных лимфоузлов (маркер 2 на рис. б)
Центральная зона некробиоза и некроза может быть визуализирована и без использования парамагнитного контрастирования [3], но его применение обеспечивает не просто механическое улучшение качества изображения. Оно позволяет получить при помощи МРТ информацию о жизнеспособности опухоли, подтверждением чего оказались данные о динамике картины МРТ легких с контрастным усилением при проспективном наблюдении за эффективность комплексной химиолучевой терапии при хирургической неоперабильности новообразования. Оказалось, что при снижении накопления контраста, по сравнению с исходным накоплением парамагнетика в опухоли, по данным исследования после комплексного лечения, прогноз лучше при большем снижении.
Наше исследование имеет целый ряд ограничений в силу его первоначального характера. В частности, мы не располагали всей полнотой морфологического материала в области лимфатических узлов, аккумулировавших парамагнетик, поэтому решение вопроса о специфичности и чувствительности МРТ легких с парамагнитным контрастированием еще предстоит сделать.
Также необходимо более широкое исследование МРТ легких с контрастированием парамагнетиками в оценке эффективности лечения. Наше первоначальное наблюдение является лишь основой для более широкого, возможно межцентрового и рандомизированного, исследования.
Безусловно, пока что МРТ грудной клетки с контрастным усилением не является методом, которому по плечу заменить собой СРКТ легких в первичной диагностике рака легкого [3]. Однако, в оценке распространенности – стадировании злокачественных поражений легких перспективность метода МР-томографии обнадёживает и, видимо, заслуживает использования, поскольку не сопровождается никаким значимым риском для пациентов.
Заключение
Таким образом, МР-томографическое исследование легких с контрастированием позволяет достоверно выявить первичную опухоль и пораженные метастатическим процессом лимфоузлы, а также оценить динамику опухолевого процесса в ходе комплексной терапии, дифференцировать опухоль и последствия, а иногда и осложнения. Уже сегодня контрастированная МРТ легких с синхронизацией по дыханию является важным методом уточняющей диагностики рака легкого, однако требует дальнейшего изучения сообразно требованиям онкопульмонологии. Представляется целесообразным развивать методы МР-томографической визуализации патологии легких не в качестве конкурентного метода по отношению к СРКТ, а как метода уточняющей диагностики и возможно – проспективной оценки эффективности лечения.

