Шум как фактор производственной среды встречается практически в каждой отрасли промышленности, в некоторых из них является одной из ведущих профессиональных вредностей. Следует отметить, что часто шум выступает не как основной, а как сопутствующий фактор производственной среды, при этом вызываемые эффекты в организме, вполне сопоставимы с эффектами, вызываемыми основными производственными факторами. Являясь мощным стрессором, производственный шум вызывает комплекс расстройств, приводящих к развитию не только нейросенсорной тугоухости, но и к другим нарушениям большинства функциональных систем организма [1–3].
Однако, до настоящего времени отсутствуют данные, показывающие динамику формирования патологии центральной нервной системы у животных при воздействии шума, связь между показателями биоэлектрической активности головного мозга и развивающимися морфологическими нарушениями структуры нервной ткани и особенностями видоспецифического поведения животных.
Цель исследования – выявить динамику формирования изменений в центральной нервной системе у экспериментальных животных при воздействии шума.
Материалы и методы исследования
Изучение влияния шума на организм проводилось на беспородных белых крысах-самцах массой 160–200 гр. Воздействие шумом осуществлялось в экспериментальной камере, в которую подавался «белый шум» интенсивностью 100 дБ. В смежном помещении размещалось оборудование для дистанционного контроля параметров шума, освещенности, микроклимата. Воздействие шумом осуществлялось в течение 4 часов в сутки непрерывно 5 дней в неделю. Всего проведено 3 серии исследований в течение 15 дней, 1 и 4-х месяцев. В соответствии с поставленными задачами было взято по 1 опытной (n = 30) и 1 контрольной (n = 30) группе для каждой серии опыта. Опытных животных помещали в изолированную камеру, доступ к пище и воде был свободен. Экспериментальных животных содержали в стандартных условиях вивария при естественном освещении в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Страсбург, 1986). Содержание, питание, уход за животными и выведение их из эксперимента осуществлялось в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных».
Все экспериментальные исследования проводили с учетом воспроизводимости. Результаты исследований, полученные во всех сериях экспериментов у животных опытных и контрольных групп сопоставимы, так как обязательным условием было использование животных одного возраста и массы, содержание их в идентичных условиях, соблюдение дозировок и стандартности методик.
Для оценки функционального состояния центральной нервной системы проводилась компьютерная электроэнцефалография (ЭЭГ), запись и обработку которой осуществляли с помощью электроэнцефалографа «Нейрон-Спектр-4» (Россия). Анализировали изменения показателей спектров ЭЭГ: общая мощность спектра, абсолютная мощность диапазонов в частотных интервалах соответствующих δ, θ, α, β1, β2-ритмам ЭЭГ. Оценивали изменение показателей зрительных (ЗВП) и слуховых вызванных потенциалов (СВП).
До начала и после окончания эксперимента у животных оценивали двигательную активность, ориентировочно-исследовательское и эмоциональное поведение по методу «открытое поле». Наблюдение вели в течение 3 минут.
После окончания эксперимента животные были декапитированы с последующим отбором биоматериала для патоморфологических исследований. Исследование структуры нервной ткани головного мозга было проведено на светооптическом исследовательском микроскопе Olympus BX 51.
Головной мозг после декапитации животных фиксировали в 10 % нейтральном формалине, с последующей проводкой и заливкой в парафин. На санных микротомах MC-2 (СССР) и HM 400 (Microm, Германия) изготовляли сагиттальные, фронтальные и горизонтальные срезы головного мозга. Приготовленные стандартные серийные срезы толщиной 3–5 мкм наклеивали на стекла, обработанные яичным альбумином. Для оценки состояния клеток головного мозга препараты окрашивали по общепринятым методикам гистологической окраски: гематоксилин-эозином – для выявления общей картины состояния нейронов и клеток глии в различных отделах головного мозга; тионином (по Нисслю) – для исследования структуры нейронов.
Информация обрабатывалась стандартными методами вариационной статистики. В работе использовались расчеты средних, медианы, межквартильных интервалов. Для всех имеющихся выборок проверялась гипотеза нормальности распределения по критерию Шапиро-Уилка. Задача сравнения значений двух выборок решалась с помощью критерия Стьюдента. Статистическая обработка данных выполнялась с помощью пакета прикладных программ EXCEL пакета Office 2003 (в ОС «Windows XP»), «Statistica for Windows – 6 версия».
Результаты исследования и их обсуждение
Анализ ЭЭГ опытных и интактных животных показал, что воздействие шума в течение 15 дней приводит к снижению амплитуды дельта ритма, к нарастанию активности волн тета- диапазона; к 4 месяцам наблюдается дальнейшее снижение средней амплитуды дельта ритма, нарастание тета, альфа, бета-1 и бета-2 ритмов. Выявленные изменения свидетельствуют о перераспределении биоэлектрической активности головного мозга при увеличивающейся продолжительности воздействия шума. Увеличение диапазона быстрых альфа волн после 4-х месяцев воздействия указывает на развитие приспособительной реакции на раздражитель. Это подтверждается и отсутствием достоверных различий между показателями ЭЭГ интактных и опытных животных после 4-х месяцев воздействия шума. Длительное воздействие шума (1, 4 месяца) приводящее к снижению амплитуды дельта-ритма (с 80,7 % до 60,5 %, р < 0,05), увеличению медленноволновой активности тета-диапазона (с 9,5 % до 16,1 %, р < 0,05), увеличению быстрых волн альфа (с 3,6 % до 9,7 %, р < 0,05) и бета- диапазонов (с 2,0 % до 4,6 %) свидетельствует о развитии стрессовой реакции животных на раздражитель.
Исследование ЗВП у опытных животных показало снижение латентности пиков N1 (с 82,0 мс до 71,0 мс, р < 0,05 ), Р3 (242,0 мс до 215,0 мс) после 4-х месяцев воздействия шума. К 4-му месяцу отмечается также снижение амплитудных показателей ЗВП Р2-N2 (с 11,0 мкВ до 5,0 мкВ) и N2-P3 (с 14,0 мкВ до 7,0 мкВ), что свидетельствует об органическом повреждении афферентных зон мозга. Анализ СВП показал, что у опытных животных после 1-го месяца воздействия шума отмечается уменьшение времени появления начала ответа (пики N2, Р3), которое наблюдается и в дальнейшем. Анализ амплитудных показателей свидетельствует о снижении амплитуды N1-Р2 (с 6,0 мкВ до 3,0 мкВ), N2-P3 (с 22,0 мкВ до 7,0 мкВ, р < 0,05) уже после 1-го месяца воздействия; после 4-х месяцев –снижение амплитуд N1-Р2 (до 4,0 мкВ), Р2-N2 (до 6,5 мкВ, р < 0,05), N2-Р3 (до 2,5 мкВ, р < 0,05).
Перед началом эксперимента достоверных различий в поведении животных опытных и контрольных групп не выявлено. Суммарное количество актов у опытных животных в динамике эксперимента было ниже по сравнению с животными контрольных групп, что свидетельствует о снижении общей двигательной активности, как при минимальной, так и максимальной длительности воздействия шума (таблица).
Сравнительный анализ поведенческой активности животных опытных и контрольных групп показал, что воздействие шума приводит к снижению спонтанной двигательной активности у опытных животных, об этом свидетельствует снижение количества актов «локомоция». Указанное, по всей вероятности, является проявлением защитного торможения, возникающего на развивающийся стресс. Следует отметить значительное снижение локомоторной активности животных, подвергавшихся воздействию шума в течение 4-х месяцев, что возможно связано с нарушением процессов перестройки высшей нервной деятельности и развитием компенсаторно-приспособительных реакций. Двигательная вертикальная активность, представленная актом «стойки», в определенной степени зависит от эмоциональности животного и наблюдаемое ее повышение после 15-дневного воздействия указывает на повышенную эмоциональную реактивность животных.
Поведенческая активность животных опытных и контрольных групп, (M ± m)
|
Поведенческий акт |
Время воздействия/группы |
|||||
|
15 дней |
1 месяц |
4 месяца |
||||
|
опыт |
контроль |
опыт |
контроль |
опыт |
контроль |
|
|
Локомоция |
6,57 ± 0,98* |
12,82 ± 1,09 |
6,73 ± 0,82 |
8,58 ± 1,13 |
4,65 ± 1,01 |
7,49 ± 1,23 |
|
Обнюхивание |
17,82 ± 0,95* |
25,77 ± 1,24 |
18,27 ± 1,21 |
21,79 ± 1,67 |
15,40 ± 1,17* |
20,35 ± 1,38 |
|
Движение на месте |
1,35 ± 0,26 |
1,01 ± 0,18 |
1,43 ± 0,26* |
0,29 ± 0,11 |
0,90 ± 0,37 |
1,80 ± 0,28 |
|
Груминг |
1,25 ± 0,26 |
0,73 ± 0,36 |
1,76 ± 0,25* |
0,87 ± 0,27 |
0,89 ± 0,35 |
1,00 ± 0,23 |
|
Стойка с упором |
2,96 ± 0,48 |
4,10 ± 0,63 |
1,96 ± 0,45 |
2,91 ± 0,46 |
1,09 ± 0,36* |
3,40 ± 0,58 |
|
Вертикальная стойка |
0,21 ± 0,09 |
0,66 ± 0,32 |
0,33 ± 0,22 |
0,37 ± 0,19 |
0,50 ± 0,30 |
0,65 ± 0,35 |
|
Норка |
3,28 ± 0,48* |
7,99 ± 0,79 |
4,59 ± 1,06* |
8,62 ± 0,79 |
3,55 ± 0,61 |
2,40 ± 0,44 |
|
Фризинг |
0,18 ± 0,11* |
0 |
0,17 ± 0,08* |
0 |
0,85 ± 0,41 |
0,80 ± 0,38 |
|
Сидит |
6,03 ± 0,41* |
2,30 ± 0,36 |
5,69 ± 0,65* |
1,79 ± 0,39 |
4,90 ± 0,51 |
5,69 ± 1,04 |
|
Суммарное количество поведенческих актов |
40,71 ± 2,32* |
56,10 ± 2,95 |
40,63 ± 2,69 |
46,16 ± 3,64 |
33,75 ± 2,73* |
44,60 ± 2,74 |
Примечание: * – различия между показателями животных опытной и контрольных групп достоверны, p < 0,05.
У животных опытных групп, подвергавшихся воздействию шума в течение 15 дней, 1 месяца, наблюдалось увеличение количества актов «груминг», который является механизмом для снятия избыточной активности ЦНС, что указывает на появление у крыс сильного эмоционального напряжения отрицательного характера – страха, беспокойства. Выраженная стрессорная активация груминга у экспериментальных животных, возможно, связана с адаптивной необходимостью снизить уровень возбуждения, вызванного влиянием стрессора. Снижение количества этого акта у животных после 4-х месяцев воздействия шума возможно связано с негативным влиянием шума на эмоциональную сферу животных. Кроме того, у этих животных наблюдалось негативно-эмоциональное состояние, выражающееся в увеличении количества актов «движение на месте», «сидит».
Количество актов «фризинг» у животных опытных групп, подвергавшихся воздействию шума в течение 15 дней и 1 месяца, увеличивалось. В то же время у животных, подвергавшихся воздействию шума в течение 4-х месяцев, количественно-временные характеристики этого акта «закрепляются» на уровне контрольной группы. Эти изменения, с одной стороны, свидетельствуют о подавлении двигательной активности животных при неблагоприятном воздействии шума, с другой стороны – о привыкании к неблагоприятному фактору и соответствующей перестройке организма.
При анализе ориентировочно-исследовательской активности крыс наблюдалась тенденция к снижению количества актов «норка» на протяжении всего эксперимента и снижению количества акта «обнюхивание» после 4-х месяцев воздействия.
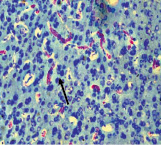
Гистологический анализ ткани головного мозга белых крыс показал, что после 15 дней воздействия шума наблюдаются морфологические нарушения, характеризующиеся нарушением работы сосудов: визуально сосуды расширены, отмечается стеноз некоторых сосудов, эндотелий утолщен (рис. 1). В ряде случаев наблюдается периваскулярный отек (наиболее часто в подкорковых структурах и стриатуме), отмечается утолщение первого слоя коры с разрыхлением нейропиля. Нейроны 2 и 4 слоя коры головного мозга гиперхромны, что, возможно, свидетельствует об усилении функциональной активности данных нейронов. Число гиперхромных нейронов составляет: 39 (33–45) в опыте, 3,7 (3,6–3,8) в контроле (р < 0,005). Общее число нейронов не отличалось от контрольного значения: 227 (197–258) в опыте и 220 (180–240) в контроле. Видимых изменений в структуре нейронов не отмечается. Наряду с этим наблюдается ярко выраженная пролиферация элементов астроглии (глиоз) – число клеток астроглии выше контрольных значений: 121 (112–130) в опыте и 58,5 (55–63) в контроле (р < 0,005).
 А
А 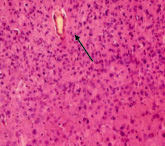 Б
Б
Рис. 1. Ткань коры головного мозга после 15 дней воздействия шума. А. Часть нейронов имеет гиперхромную окраску (↑). Кровеносные сосуды расширены. Окраска тионином по Ниссля. Ув. Х 400.Б. Стеноз сосудов незначительный, периваскулярный отек (↑). Окраска гематоксилином и эозином. Ув. Х 400
После воздействия шума в течение 30 дней наблюдается набухание и разрыхление мягкой оболочки головного мозга, возможно в результате нарушений метаболических процессов, связанных со стенозом и утолщением эндотелия, отмечавшихся ранее (рис. 2), а также снижением общего числа нейронов на единицу площади по сравнению с контролем: 159 (159–160) в опыте, 220 (180–240) в контроле (р < 0,005). Ярко выраженное полнокровие сосудов головного мозга и периваскулярный отек, наблюдаемые после 15 дневного воздействия шума, в данном периоде не отмечены. Область гиппокампа не имела отличий от контроля. Нейроны 2 слоя коры головного мозга по-прежнему сохраняют гиперхромную окраску, что свидетельствует о продолжающейся повышенной функциональной активности данного участка коры. Число гиперхромных нейронов снизилось по сравнению с предыдущим периодом, но по-прежнему значительно выше контрольного значения: 31,5 (26–37) в опыте и 2,0 (1,0–3,0) в контроле (р < 0,005). Также в данный период сохраняется реактивный глиоз: 121 (116–132) в опыте и 58,5 (55–63) в контроле (р < 0,005).
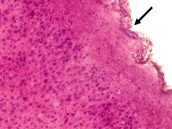
Рис. 2. Ткань коры головного мозга после 1 месяца воздействия шума. Утолщение и разрыхление эпендимы (↑) и первого слоя коры. Гиперхромность нейронов. Окраска гематоксилином и эозином. Ув. Х 400
После 4-х месяцев воздействия шума в тканях коры головного мозга отмечается резкое снижение общего числа нейронов на единицу площади (121 (111–131) в опыте и 200 (172–240) в контроле) по сравнению не только с контрольной группой, но и с аналогичным показателем ранее обследованных опытных групп, что связано с истощением клеток, и, как следствие их гибелью. В ряде препаратов наблюдается наличие небольших глиальных рубцов в области 2 слоя коры, что свидетельствует о значительных нарушениях данной области головного мозга. Число клеток астроглии, как показатель интенсивности глиоза, выше по сравнению со значениями в предыдущих группах и составляет: 133 (126–140) в опыте и 55 (52–57) в контроле (р < 0,005), что указывает на сохраняющийся астроглиоз. Число гиперхромных клеток, напротив, значительно снижено по сравнению с предыдущими группами и составило: 12 (10–14) в опыте и 2 (2–3) в контроле. (р < 0,005) (рис. 3).
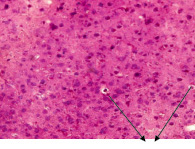
Рис. 3. Ткань коры головного мозга после 4-х месяцев воздействия шума. Вакуолизация нейронов (1). Гиперхромность нейронов. Окраска гематоксилином и эозином. Ув. Х 400
После 4-х месяцев воздействия шума в ткани коры головного мозга отсутствует периваскулярный отек, который наблюдался после 15 дней воздействия. В целом, учитывая снижение общего числа клеток, сохраняющийся астроглиоз можно отметить, что воздействие шума в течение 4-х месяцев приводит к более выраженным морфологическим изменениям в головном мозге животных.
Выводы
1. Выявленные изменения функциональной активности головного мозга свидетельствуют о развитии защитной реакции организма на воздействие шума на первых этапах и органических изменений после длительного его воздействия.
2. Результаты исследования поведенческих реакций животных при хроническом воздействии шума свидетельствуют о снижении общей двигательной активности, повышении тревожности и снижении эмоциональной активности животных.
3. Патоморфологические исследования свидетельствуют о появлении нарушений сосудистого характера, необратимых изменений в нервной ткани при минимальном воздействии шума, проявляющиеся снижением общего числа нейронов на единицу площади, увеличением числа гиперхромных нейронов, развитием глиоза с образованием глиальных рубцов в области 2 слоя коры, нарастающих при продолжающемся воздействии шума, что подтверждается данными компьютерной ЭЭГ.
4. Выявлены взаимосвязанные адаптационные изменения при непродолжительном воздействии шума на животных, проявляющиеся в увеличении амплитудных показателей биопотенциалов мозга, усилении двигательной активности животных и изменении реактивности сосудов. Длительное воздействие шума приводит к развитию выраженных изменений в нервной системе, которые проявляются депрессией амплитудных показателей биопотенциалов мозга, нарастанием медленноволновой патологической активности и сопровождаются структурными изменениями мозговой ткани, снижением двигательной активности животных, что свидетельствует о срыве адаптационных механизмов гомеостаза.

