Пектолитические ферменты, катализирующие реакции расщепления пектиновых веществ [8], имеют большое промышленное значение в различных отраслях биотехнологии: при получении пектинов [10]; при обработке текстильных волокон [4]; для получения пищевых красителей и танинов [7]; для интенсификации производства соков из плодово-ягодного сырья [2, 9]; в виноделии [3]. Актуальность вопроса о рентабельном производстве пектиназ связана, в первую очередь, с поиском новых высокоактивных продуцентов. Получение высокопродуктивного штамма с помощью методов селекции дает возможность повысить выход готовой продукции на единицу биомассы и понизить его себестоимость. Постоянный поиск новых штаммов, а также селекция отобранных штаммов методом ступенчатого стабилизирующего отбора и индуцированного мутагенеза позволяет создать высокорентабельную технологию производства современных ферментных препаратов [5].
Ярко выраженной способностью к биосинтезу пектолитических ферментов обладают микроскопические грибы рода Aspergillus, т.к. они обладают высоким уровнем белковой секреции, широким диапазоном продуцируемых пектолитических ферментов, кроме того, они безопасны при использовании в пищевой промышленности [1]. Грибы рода Aspergillus очень быстро размножаются с помощью спор и дают огромное количество колоний за сравнительно короткое время. Уже в первом поколении наблюдается фенотипическое проявление хозяйственно ценных мутаций. Благодаря этим свойствам они являются удобным объектом для селекции [6]. Целью исследований является проведение селекционных работ с тремя наиболее продуктивными и перспективными продуцентами пектиназ, выделенными из почв Южно-Казахстанской области, пшеничного зерна, свежего винограда и виноградных выжимок.
Материалы и методы исследований
Отобраны следующие продуценты пектиназ: А. foetidus (из пшеничного зерна Тюлькубасского района, с. Ынтымак) с общей пектолитической активностью 0,30 ед/мл, A. niger с пектолитической активностью 0,25 ед/мл (с кожицы виноградных выжимок сорта Баян ширей винодельческого завода «Молчанов и К») и A. аwamori с общей пектиназной активностью 0,22 ед/мл (с кожицы виноградных выжимок сорта Саперави винодельческого завода «Нур»).
Выявление наиболее активных штаммов проводили высевом 7-ми дневной споровой суспензии исходных штаммов на чашки Петри, содержащие селективные агаризованные среды из яблочного, арбузного, цитрусового, виноградного пектина, и посевы выращивали в течение 4-х суток при 30 °С до формирования колоний.
Для получения гиперпродуцента пектолитических ферментов, на первой ступени селекции суспензию спор (титр разведения – 10-4–10-6) отобранных штаммов A. foetidus 66-2, A. awamori 56-2 и A. niger 86-2 высеяли на чашки Петри с селективными агаризованными средами, содержащими арбузный и виноградный пектин и подвергли облучению монохроматором «ЛМ-3» длиной волны λ = 530 нм и мощностью светового потока 2–4 Вт/м2 в течение 2–5 суток при 28 °С. Интенсивность синтеза пектиназ мутантных клонов тестировали по величине отношения диаметра окрашенных зон гидролиза к диаметру колонии (D = Dозг/Dк). На второй ступени селекции в питательную среду была введена лактоза в концентрации 0,1 %. На третьей ступени селекции суспензию конидий (титр разведения – 10-4–10-6) обрабатывали нитрозометилмочевиной в концентрации 0,1 % в течение 1–4 ч. Облучение проводили по схеме первой ступени селекции.
Культивирование полученного мутантного штамма проводили на жидкой питательной среде состава, масс. %: свекловичный жом : виноградные выжимки : хлопковые створки (1:1:1) – 3, солодовые ростки – 1, (NH4)2SO4 – 0,1, KH2PO4 – 0,1, MgSO4–0,1. Культивирование проводили в течение 72 ч при температуре 24° C и рН – 3,2.
Активность пектолитического комплекса ферментов определяли по методике действующего ГОСТ 20264.3-81.
Статистическую оценку достоверности результатов проводили по общепринятым методам с использованием компьютерных прикладных программ «MathCAD» и «Statistica». Достоверность полученных результатов обеспечивается корректным набором экспериментально-измерительных средств и методов обработки экспериментальных результатов. Примененная в исследовании аппаратура откалибрована по эталонам.
Результаты исследования и их обсуждение
На первом этапе ступенчатого скрининга в два цикла пересева был произведен отбор наиболее активных штаммов, выращенных на селективных питательных средах. На основании морфологических признаков (диаметр колонии), нами были выделены колонии, вокруг которых имелись интенсивно окрашенные зоны гидролиза, эти колонии были пересеяны в жидкую среду для определения пектолитической активности. В результате первичного скрининга нами было получено более 300 различных образцов исходных штаммов A. аwamori, A. niger и A. foetidus. В зависимости от состава селективной среды отобранные штаммы проявляли различную пектолитическую активность при культивировании на агаризованных средах в течение 4-х суток. Так, штамм A. foetidus наиболее продуктивен на агаризованной среде, содержащей в качестве источника углерода арбуз, а штаммы A. аwamori и A. niger на виноградной среде (рис. 1).
В табл. 1 приведены результаты отбора наиболее продуктивных штаммов. Было отобрано 15 изолятов, отличающихся морфологическими признаками и высоким уровнем биосинтеза пектиназ.
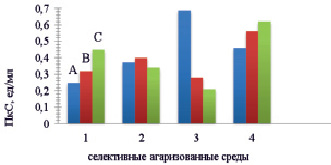
Рис. 1. Биосинтез пектиназ в зависимости от состава селективных сред. Условия: вариант среды: 1 – яблочный пектин; 2 – цитрусовый пектин; 3 – арбузный пектин; 4 – виноградный пектин; штамм: А – А. foetidus; В – A. аwamori; С – A. niger
Таблица 1
Результаты скрининга наиболее продуктивных штаммов A. foetidus, A. аwamori и A. niger
|
Исходный штамм |
Штамм |
Селективная среда |
Средний размер колонии, мкм |
КОЕ/г*10-6 |
ПкС, ед/мл |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
А. foetidus |
A. foetidus 12 |
2 |
20–25 |
10,4 |
0,45 |
|
A. foetidus 70 |
4 |
20–25 |
5,8 |
0,53 |
|
|
A. foetidus 66 |
3 |
25–30 |
15,3 |
0,84 |
|
|
A. foetidus 255 |
3 |
20–25 |
11,8 |
0,57 |
|
|
A. foetidus 18 |
1 |
25–30 |
8,5 |
0,42 |
|
|
Окончание табл. 1 |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
A. аwamori |
A. аwamori 25 |
2 |
25–30 |
11,6 |
0,63 |
|
A. аwamori 56 |
4 |
25–30 |
15,8 |
0,76 |
|
|
A. аwamori 179 |
1 |
25–30 |
9,8 |
0,60 |
|
|
A. аwamori 17 |
3 |
20–25 |
14,5 |
0,52 |
|
|
A. аwamori 6 |
4 |
20–25 |
13,6 |
0,69 |
|
|
A. niger |
A. niger 86 |
4 |
25–30 |
12,8 |
0,80 |
|
A. niger 165 |
2 |
25–30 |
16,0 |
0,40 |
|
|
A. niger 36 |
4 |
20–25 |
10,3 |
0,60 |
|
|
A. niger 124 |
1 |
20–25 |
11,7 |
0,73 |
|
|
A. niger 12 |
1 |
20–25 |
11,0 |
0,68 |
|
Примечание: Селективные агаризованные среды, содержащие пектин: 1 – яблочный; 2 – цитрусовый; 3 – арбузный; 4 – виноградный.
Как видно из данных табл. 1, наибольшей пектолитической активностью обладают штаммы A. foetidus 66 с активностью 0,84 ед/мл, A. niger 86 с активностью 0,80 ед/мл и штамм A. awamori 56, активность которого составила 0,76 ед/мл.
Колонии этих штаммов были вновь пересеяны на среды с трудногидролизуемыми субстратами, такими как арбузный пектин для A. foetidus 66, виноградный пектин для A. аwamori 56 и A. niger 86 и культивировали в течение 4-х суток при 30 °С. В результате вторичного скрининга из 15 полученных штаммов нами было отобрано 3 штамма, наиболее активно синтезирующие пектиназу: A. foetidus 66-2 (1,01 ед/мл); A. awamori 56-2 (0,83 ед/мл); A. niger 86-2 (0,88 ед/мл). Полученные в результате ступенчатого скрининга микроорганизмы послужили исходным материалом для последующей селекционной работы.
Применение методов многоступенчатой селекции с использованием физических (УФ-облучение, рентгеновское облучение, ультразвук и т.д.) и химических (нитрозогуанидин, нитрозометилмочевина и др.) мутагенов позволяет повысить частоту мутаций и получить активные штаммы микроорганизмов-продуцентов. Однако классические мутагенные факторы (ионизирующая радиация, химические мутагены) оказывают грубое действие на генетические структуры клетки, а полученные мутанты имеют пониженную жизнеспособность и продуктивность, что затрудняет их использование в селекционной практике. В настоящее время ведется поиск новых малотоксичных мутагенов, дающих высокий выход селекционно-ценных мутаций.
На втором этапе отбора для получения гиперпродуцента пектолитических ферментов, суспензию спор (титр разведения – 10-4–10-6) отобранных штаммов высеяли на чашки Петри с селективными агаризованными средами и подвергли облучению монохроматическим светом длиной волны λ = 530 нм и мощностью светового потока 2–4 Вт/м2 в течение 2–5 суток при 28 °С.
Отобранные из 100 одинаковых колоний 11 вариантов с наилучшими морфологическими признаками культивировали на жидких средах для определения общей пектолитической активности. Как видно из данных табл. 2, наибольшая зона гидролиза наблюдалась у штамма A. awamori 56-2 при облучении его спор световым потоком мощностью 3,5 Вт/м2 в течение 3 суток. На этом этапе отбора пектолитическая активность штамма A. аwamori 56-2 повысилась на 25 % и составила 1,04 ед/мл.
Таблица 2
Влияние условий облучения на интенсивность синтеза ферментов
|
Условия облучения |
Отношение Dозг / Dк |
Выживаемость*, % |
|||
|
Мощность, Вт/м2 |
Время, сут |
A. foetidus 66-2 |
A. awamori 56-2 |
A. niger 86-2 |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
2 |
2 |
1,2 |
1,3 |
1, 3 |
50/58/62 |
|
3 |
1,2 |
1,4 |
1, 6 |
41/52/56 |
|
|
4 |
1,3 |
1,4 |
1, 6 |
34/48/52 |
|
|
5 |
1,3 |
1,8 |
1,6 |
22/29/38 |
|
|
Окончание табл. 2 |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
2,5 |
2 |
1,5 |
1, 8 |
1,7 |
45/52/60 |
|
3 |
1,7 |
1,9 |
1,7 |
38/49/54 |
|
|
4 |
1,8 |
1,7 |
1,5 |
31/39/46 |
|
|
5 |
1,8 |
1,7 |
1,4 |
20/31/37 |
|
|
3 |
2 |
2,0 |
2,2 |
1,5 |
24/30/33 |
|
3 |
2,2 |
2,3 |
1,8 |
14/21/20 |
|
|
4 |
1,8 |
2,5 |
1,7 |
4/8/7 |
|
|
5 |
1, 4 |
2,0 |
1,7 |
2/4/3 |
|
|
3,5 |
2 |
1,4 |
2,7 |
2,1 |
1/2/1 |
|
3 |
1,4 |
3,0 |
2,3 |
0,5/1/0 |
|
|
4 |
1 |
2,8 |
1 |
0/0,5/0 |
|
|
5 |
1 |
1 |
1 |
0/0/0 |
|
|
4 |
2 |
1,2 |
1,5 |
1,7 |
0,6/0,3/0,3 |
|
3 |
1,2 |
1 |
1 |
0,5/0/0 |
|
|
4 |
1 |
1 |
1 |
0/0/0 |
|
|
5 |
1 |
1 |
1 |
0/0/0 |
|
Примечание: * A. foetidus 66-2/ A. awamori 56-2/ A. niger 86-2.
На второй ступени селекции наиболее продуктивный вариант высеяли на селективные агаризованные среды, содержащие виноградный пектин и лактозу 0,1 %, которая в определенных условиях обладает свойствами индуктора ферментов и снова подвергли облучению монохроматическим светом длиной волны λ = 530 нм и мощностью светового потока 3,5 Вт/м2 в течение 3 суток при 28 °С и (рис. 2).
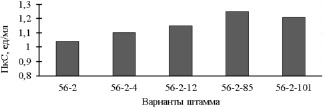
Рис. 2. Результаты работ второй ступени селекции. Условия культивирования: рН – 3,2, t – 24 °C, τ = 72 ч, состав, масс. %: свекловичный жом : виноградные выжимки: хлопковые створки (1:1:1) – 3, солодовые ростки – 1, (NH4)2SO4 – 0,1, KH2PO4 – 0,1, MgSO4–0,1
На данном этапе отбора выделено 5 вариантов из 50 с повышенной способностью к образованию пектолитических ферментов. Наибольшая активность пектиназы наблюдалась у варианта A. аwamori 56-2-85, которая составила 1,25 ед/мл, что на 20 % превышала активность предыдущего мутанта.
Для дальнейшего повышения физиологической активности отобранного штамма была проведена третья ступень селекции, в которой получен мутант A. аwamori 56-2-85-375 в результате комбинированного действия нитрозометилмочевины и монохроматического света (рис. 3). Суспензию конидий (титр разведения – 10-4–10-6) пересеяли на среду, содержащую виноградный пектин и лактозу с концентрацией 0,1 % и обрабатывали нитрозометилмочевиной в концентрации 0,1 % в течение 1–4 ч, одновременно индуцируя монохроматическим светом в течение 3-х суток мощностью светового потока 3,5 Вт/м2 при 28 °С по схеме, описанной выше.
В результате третьей ступени селекции получен высокоактивный штамм A. awamori 56-2-85-375, активность которого составила 1,65 ед/мл.
Были исследованы морфологические и биохимические характеристики полученного мутантного штамма A. аwamori 56-2-85-375. Штамм A. awamori 56-2-85-375 не обладает патогенными свойствами, температурный оптимум роста составляет 28–30 °С, дыхание аэробное. Культура штамма хорошо усваивает такие углеводы, как глюкозу, сахарозу, арабинозу, рафинозу, лактозу. Среди источников азота хорошо ассимилирует аммонийные соли неорганических кислот, пептон, казеин.
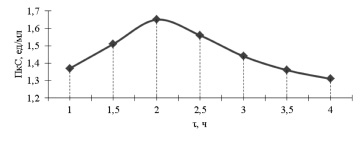
Рис. 3. Результаты работ третьей ступени селекции штамма A. аwamori 56-2-85. Условия культивирования: см. рис. 2; условия облучения: см. табл. 2
Вегетативное тело мицелиального гриба A. awamori 56-2-85-375 имеет очень ветвистый мицелий, пронизывающий субстрат. Конидиеносцы слабо окрашены в коричневый цвет, имеют гладкую поверхность и состоят из ветвящихся клеток. Верхняя часть конидиеносца вздутая и образует шаровидные головки, диаметр которых 20–40 мкм. На них пучками расположены фиалиды, размеры которых колеблются в пределах 5–8 мкм в длину и 2–4 мкм в ширину. Стеригмы представляют собой двухъярусные короткие цилиндрические клетки. Метулы, расположенные на вершине конидиеносца в виде пучка, имеют размеры от 6–10 до 3–7 мкм. Конидии гладкие, в основном имеют круглую форму и окрашены в серовато-коричневый цвет.
Макроскопические характеристики штамма A. awamori 56-2-85-375 на сусло-агаре, на агаре Чапека и Мальц-агаре имеют отличительные признаки, указанные в табл. 3.
Таблица 3
Макроскопические характеристики штамма A. awamori 56-2-85-375
|
Признаки |
Морфологические характеристики |
||
|
Питательная среда |
|||
|
Сусло-агар |
Агар Чапека |
Мальц-агар |
|
|
Форма и диаметр колоний |
Круглые, гладкие, 20–25 мкм |
Круглые, радиально-бороздчатые, 30–35 мкм |
Круглые, радиально-бороздчатые, 35–40 мкм |
|
Поверхность колоний |
Клочковато-шершистая |
Бархатистая |
Клочковато-шершистая |
|
Край колоний |
Неровный, тонкий |
Неровный, тонкий |
Неровный, тонкий |
|
Цвет конидиальной области |
Темно-коричневый |
Серовато-коричневый |
Темно-серый |
|
Экскудат |
Отсутствует |
Отсутствует |
Отсутствует |
|
Обратная сторона колоний |
Тускло-желтая |
Тускло-желтая |
Тускло-желтая |
Заключение
В результате ступенчатого срининга и индуцированного мутагенеза после трехкратного облучения монохроматическим светом и обработки спор нитрозометилмочевиной получен получен новый активный штамм A. аwamori 56-2-85-375 с общей пектолитической активностью 1,65 ед/мл, которая превышала по общей пектолитической активности у исходного дикого штамма A. аwamori в 7,5 раз. В результате исследования свойств нового штамма в течение 6 месяцев сделан вывод о его стабильности и необратимости наследственной изменчивости, вызванной перестройкой наследственного аппарата микроорганизма. Полученный мутант по своим морфологическим свойствам отличается от исходного интенсивностью спороношения, цветом пигмента спор, окраской колонии с обратной стороны при выращивании на агаризованных средах, более коротким циклом роста, образованием более обильной биомассы, повышенной способностью к биосинтезу пектолитического фермента при глубинном культивировании на жидких средах.

