Целью работы являлось установление оптимальных параметров работы электролизера при получении хлорсодержащих окислителей.
В ходе проведения экспериментальных исследований было рассмотрено влияние на выход «активного хлора» таких параметров процесса как: плотности тока на электродах и продолжительность электролиза; температура реакционной смеси.
В процессе электролиза хлоридсодержащих растворов на аноде выделяется [5, 9]:
– молекулярный кислород, в результате разложения гидроксид-ионов и молекул воды:
4ОН¯– 4e → 2H2O + О2 и
4 H2O – 4e → 4H+ + О2
– молекулярный хлор, при разряде хлорид-ионов, который затем в слабокислой и нейтральной среде гидролизуется, образуя хлорид-ионы и кислородсодержащие соединения хлора – «активный хлор»:
2Cl¯ – 2e → Cl2 и Cl2 + H2O →
→ H+ + Cl¯ + HClO
На катоде в основном происходит образованию молекулярного водорода и гидроксид-ионов в результате разряжения молекул воды и восстановления катионов водорода:
2H2O + 2e → H2 + 2OH- и 2H+ + 2e → H2
Наряду с основными реакциями, как на электродах, так и в объеме электролита возможно протекание и побочных реакций, снижающих выход основных веществ по току:
– на аноде разряжение молекул воды и ионов гипохлорита по реакциям:
2H2O – 4e → O2 +4H+ и 6ClO¯ +
+ 3H2O – 6e → 2ClO3- +4Cl¯ +6H+ + 3/2O2
– на катоде частичное восстановление ионов гипохлорита по реакции:
2ClO- + H2O + 2e → 2Cl- + 2OH-
В объеме электролита при повышенных температурах может протекать реакция химического образования хлорат-иона:
3ClO¯ → ClO3¯ + 2Cl¯
Следует также отметить, что эффективность процесса электролиза зависит от:
– типа и материала электродов. При получении хлорсодержащих окислителей – «активного хлора» путем электролиза растворов хлорида натрия наиболее значимым является выбор материала анодов ввиду того, что процессы, протекающие на аноде, во многом определяют концентрацию и активность образующихся окислителей [1, 2, 10];
– плотности тока на электродах и времени электролизной обработки, т.к. изменение данных параметров работы электролизера существенно влияет на: выход по току «активного хлора», степени превращения хлорид ионов в «активный хлор», а так же на возможность доминирования побочных продуктов электролиза (образование СlO2¯, СlO3¯ и СlO4¯, обладающих значительно меньшими окислительными свойствами) [6, 9];
– температуры электролита, т.к. повышение температуры растворов, как известно, приводит к увеличению скорости химических реакции, а так же может способствовать протеканию побочных процессов. [9, 10].
Анализ литературных данных показал, что для получения хлорсодержащих окислителей электрохимическим способом наибольшее распространение находят малоизнашивающиеся аноды на титановой основе [1, 2] с активными покрытиями, такими как магнетит, сплавы на серебре, платиново-иридиевые, оксиды железа, свинца, марганца, кобальта и палладия [1, 10].
В результате электродных процессов в прианодном слое всегда наблюдается кислая среда, а в прикатодном – щелочная, поэтому межэлектродном пространстве от анода к катоду рН среды раствора изменяется от кислого к щелочному, не зависимо от рН исходного раствора. Следовательно, в межэлектродном пространстве всегда есть области с нейтральным рН. Существование нейтральных областей рН и постоянная ионизация воды (вследствие пропускания электрического тока) создают благоприятные условия для протекания процесса окислительной электрокоагуляции ионов поливалентных металлов из растворов в виде дисперсной фазы под действием образующихся кислородных соединений хлора. При этом ионы Н+ и ОН− выступают как катализаторы процесса [4, 8]. Так же следует отметить, что в результате катализирующего действия ионов поливалентных металлов (Mn2+, Fe2+ и др.) на процесс восстановления «активного хлора», протекающий с образованием атомарного кислорода и хлорид-ионов, происходит постепенное подкисление реакционной смеси вследствие образования соляной кислоты и вовлечения ионов гидроксила в окислительно-восстановительный процесс [1, 10].
Следует так же учитывать что, в ходе электрообработки хлоридсодержащих растворов, на аноде, в зависимости от рН растворов возможно образование нескольких форм хлорсодержащих окислителей: Сl2, НСlО, СlО–, характеризующихся разной окислительной активностью. Сравнительный анализ значений стандартных окислительно-восстановительных потенциалов показал, что максимальной окислительной активностью обладает НСlО, образование которой возможно в диапазоне рН от 3,5 до 7,5 [5, 7].
Эффективность протекания процесса электролиза определяли по следующим параметрам: выход по току «активного хлора»; степень превращения хлорид-ионов [3]; расход электроэнергии на объем обработанного раствора и расход электроэнергии на получение 1 кг «активного хлора».
В эксперименте использовали модельные растворы с концентрацией хлорида натрия 10 г/дм3. Электролиз всех модельных растворов проводили при плотностях тока 100; 200; 400 и 600 А/м2 в течение 0,5; 1,5; 3 и 5 минут. Полученные экспериментальные данные представлены на рис. 1 и 2.

Рис. 1. Влияние плотности тока на выход хлорсодержащих окислителей
Представленные зависимости на рис. 1 и 2 показали, что максимальная концентрация хлорсодержащих окислителей в электролизном растворе образуется при плотности тока на электродах 750 А/м2 и времени электролиза 5 и 10 минут, а так же при плотности тока на электродах 500 А/м2
и электролизной обработке в течение 5 и 10 минут. Причем, следует отметить, что при плотности тока 750 А/м2 концентрация «активного хлора» после электролизной обработки раствора хлорида натрия в течение 5 минут остается практически неизменной.
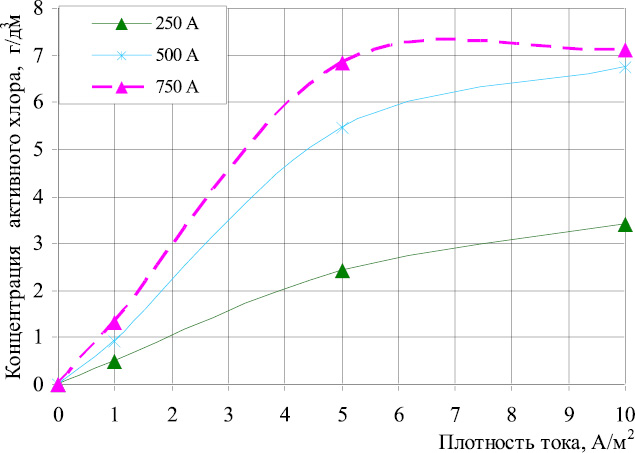
Рис. 2. Влияние времени электролизной обработки на выход хлорсодержащих окислителей
При проведении исследований на лабораторном электролизере было отмечено, что в процессе электрообработки растворов хлорида натрия происходило нагревание реакционной смеси. В ходе экспериментальных исследований было установлено, что при увеличении температуры раствора в процессе электролиза до 33 °С при обозначенных оптимальных режимах работы электролизера, эффективность получения хлорсодержащих окислителей не снижается.
Таким образом, результаты проведенных исследований показали что максимальные значения выхода по току хлорсодержащих окислителей в растворе и минимальные значения энергозатраты получены при продолжительности электрообработки раствора в течение
5 минут и плотности тока на электродах 500 А/м2. Исходная концентрация хлорида натрия в растворе 10 г/дм3.

