Классическими вариантами создания экспериментального поражения печени с целью изучения механизмов патогенеза и последующего поиска новых гепатопротекторных средств, является модель токсического гепатита, вызванная введением лабораторным животным тетрахлорметана (CCl4) [1, 4, 5, 8, 9, 10]. И, несмотря на то, что проявления такого гепатита достаточно описаны, но в современной научной литературе по медицине и токсикологии очень мало данных с учетом временной организации, а в имеющихся работах, как правило, описывается лишь роль циркадианных биоритмов, в то время как изучению длиннопериодичных циклов, практически, не уделяется внимание, а при постановке хронических экспериментов, или при повторном проведении относительно коротких опытов, но в другое время года, полученные результаты могут значительно отличаться друг от друга, поэтому их объединение и трактовка как едино целое не совсем корректна. В связи с чем целью настоящей работы явилось изучение годовой динамики образования продуктов перекисного окисления липидов в модели тетрахлорметанового острого токсического гепатита у крыс.
Материалы и методы исследования
Опыты проводили четыре раза в году: марте, июне, октябре и в декабре, используя каждый раз по 40 крыс-самцов линии Wistar одинакового возраста (по 90 ± 5 дней, всего 160 голов). Во время экспериментов все животные находились на стандартной диете вивария со свободным доступом к пище и воде в условиях естественного освещения и непродолжительное время искусственного неяркого освещения, при температуре 20–24 °С.
Во время проведения опытов животных делили на две группы по 20 особей в каждой: экспериментальная и контрольная. Крысам опытной группы однократно через зонд в желудок вводили тетрахлорметан в дозе 0,2 мл/100 г, который смешивали с аналогичным объемом оливкового масла так как тертрахлорметан нерастворим в воде, то есть токсикант вводили в виде 50,0 % масляного раствора в объеме 0,4 мл/100 г [4, 5] или же в меньшей дозе, но несколько раз [9].
Все проводимые мероприятия по введению крысам гепатотоксина соответствовали рекомендациям, описанным в руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ [3].
Временная структуру эксперимента состояла во введение затравок животным в 1100 (накануне опытов вечером крыс пересаживали в чистые клетки и не давали пищи), кормлением через пару часов и через сутки взятием крови из сердца, которое осуществлялось после внутрибрюшинного введения 0,1 мл/100 г общего анестетика в виде аптечного препарата «Золетила» (Франция), состоящего из тилетамина гидрохлорида (анестетик диссоцированного действия, не оказывающий угнетающего влияния на дыхательную систему) и золазепама гидрохлорида (усиливает анестетическое действие тилетамина, вызывает седативное действие, предотвращает судороги, ускоряет восстановление после наркоза). В плазме крови спектрофотометрически определяли содержание гидроперекисей (ГП), а в эритроцитах – малоновый диальдегид (МДА) и активность каталазы (КТ) [2, 6].
О создании модели токсического поражения печени после введения крысам гепатотоксиканта судили по морфологической картине, полученной при световой микроскопии (увеличение в 600 и 1500 раз), после предварительной фиксации биоматериала в 10,0 % растворе формалина, изготовления срезов толщиной 7–8 мкм и их окраски гематоксилин-эозином. Содержание животных и постановка опытов проводились в соответствии с приказом Минздравсоцразвития России № 708н от 23 августа 2010 года «Об утверждении Правил лабораторной практики».
Полученные результаты статистически обрабатывали, используя параметрический метод сравнения средних величин (M ± m), достоверность отличий оценивалась по t-критерию Стьюдента.
Результаты исследования
и их обсуждение
Введение крысам тетрахлорметана сопровождается развитием оксидативного стресса в результате того, что на микросомах гепатоцитов образуются трихлорметильные радикалы, инициирующие процессы пероксидации липидов [7], при этом степень выраженности печеночной патологии коррелирует с интенсивностью процессов липопероксидации.
Для уверенности в том, что описанные ниже результаты биохимических исследований обусловлены токсическим влиянием тетрахлорметана на печень, начнем с данных гистологических исследований, которые, с учетом того, что опыты ставились во все сезоны года, также проводились четыре раза, но так как при этом не было выявлено каких-либо существенных отличий в зависимости от времени года, представленное описание морфологической характеристики печени является обобщённым, а фотографии выбраны из наиболее полностью отражающих это состояние. Итак, введение крысам тетрахлорметана вызвало (рис. 1) неравномерное от слабого до умеренного кровенаполнение синусоидных капилляров и такое же неодинаковое, но уже до выраженной степени, расширение перисинусоидальных пространств Диссе. При этом на фоне значительной очагово-диффузной крупнокапельной жировой и гидропической дистрофии гепатоцитов, балочно-радиарное строение долек было стерто. И несмотря на то, что в сохранившихся печёночных клетках отмечались признаки деления ядерного материала, одновременно во многих местах в пределах среднеочаговых долек отмечался некроз гепатоцитов, который в отдельных дольках доходил до субтотального. То есть отмеченные изменения после однократного введения тетрахлорметана можно охарактеризовать как токсический гепатит.
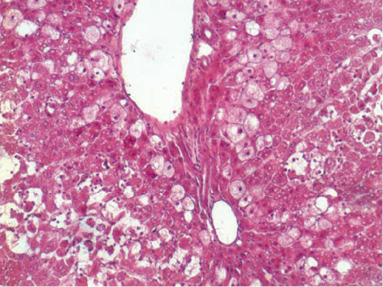
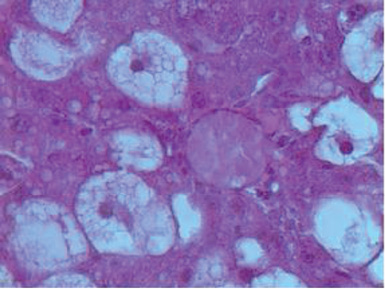
Рис. 1. Морфология печени крыс через сутки после однократного
введения тетрахлорметана. Окраска гематоксилин-эозином (х600 и 1500)
Результаты содержания гидроперекисей и малонового диальдегида
контрольных групп в течение года были по гидроперекисям следующими: в марте – 5,72 ± 0,19 мкмоль/л, в июне – 7,21 ± 0,26 мкмоль/л, в октябре – 7,23 ± 0,75 мкмоль/л и 8,08 ± 0,28 мкмоль/л в декабре.
Содержание малонового диальдегида мембран эритроцитов у крыс интактной группы весной было 54,02 ± 0,77 мкмоль/л, оставшись неизменным (54,52 ± 0,59 мкмоль/л) летом, а осенью и зимой стало меньше – 36,38 ± 2,76 и 47,96 ± 1,36 мкмоль/л соответственно.
То есть, минимальным содержание гидроперекисей в плазме крови крыс было весной и максимальным – зимой, отличаясь друг от друга на 41,25 %, а летом и осенью полученные результаты были почти одинаковыми. В отличие от этого уровень малонового диальдегида был минимальным осенью и максимальным зимой и летом, с отличием в 33,2 %.
Введение крысам тетрахлорметана вызвало статистически значимое увеличение содержания гидроперекисей (рис. 2) во все исследуемые периоды, и в марте, по сравнению с результатами интактных животных, превышение было на 42,5 % (р < 0,001), в июне на 21,2 % (р < 0,01), в октябре на 42,8 % (р < 0,002) и на 70,3 % (р < 0,001) в декабре. А по содержанию малонового диальдегида (рис. 3) отмечались не столь однонаправленные изменения, в частности, весной и летом отмечалось снижение на 6,6 % и 9,7 %, но без статистически достоверного отличия, а осенью и зимой – повышение на 33,2 % и 20,9 %, уже имеющее статистически значимые (р < 0,001) отличия.
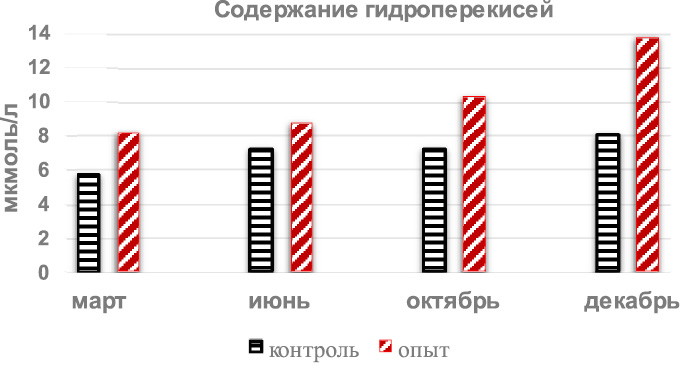
Рис. 2. Годовая динамика содержания гидроперекисей в плазме крови крыс
после однократного введения тетрахлорметана
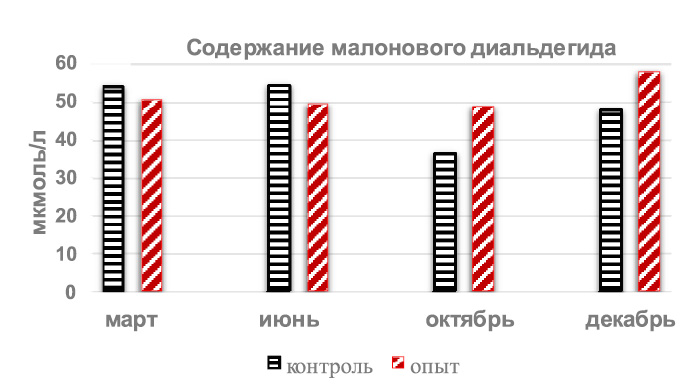
Рис. 3. Годовая динамика содержания малонового диальдегида в эритроцитах
крыс после однократного введения тетрахлорметана
Изучение активности каталазы эритроцитов (рис. 4) показало, что активность фермента антиоксидантной защиты у интактных крыс по сезонам года не изменялась существенным образом, а отмеченные колебания были в пределах статистических флуктуаций от 6,85 ± 0,42х10-4МЕ на один грамм гемоглобина (минимальная активность летом) до 7,35 ± 0,52х10-4МЕ/г Hb (максимальная активность осенью). Введение гепатотоксиканта вызвало тенденцию к снижению активности фермента, особенно осенью и зимой, но при этом результаты в октябре и декабре были практически одинаковыми, что очевидно было обусловлено тем, что значительное (на 70,3 %) увеличение зимой уровня первичного продукта пероксидации липидов гидроперекисей, осенью было компенсировано более выраженным увеличением (на 33,2 %) малонового диальдегида, являющегося вторичным продуктом перекисного окисления липидов.
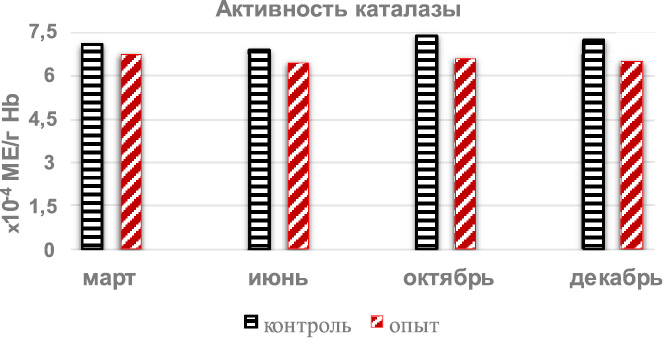
Рис. 4. Годовая динамика активности каталазы эритроцитов крыс
после однократного введения тетрахлорметана
Таким образом, в марте, июне, октябре и декабре у крыс линии Wistar одинакового возраста содержания в крови гидроперекисей и малонового диальдегида имеют статистически достоверные отличия, в то время, как активность каталазы сохраняет относительное постоянство. Введение тетрахлорметана вызывает токсическое поражение печение и усиливает процесс перекисного окисления липидов, особенно в осенне-зимнее время, с одновременным ослаблением антиоксидантной защиты. При этом в условиях патологии расхождение между максимальными и минимальными значениями оказываются более выраженными, что необходимо учитывать при создании моделей токсического повреждения структур печени.

