Роль цитокинов при психических расстройствах определяется не только их участием в развитии иммунного ответа, но и обеспечением афферентации в сложных нейроиммунных взаимодействиях. В современной литературе анализируются механизмы цитокин-индуцированных депрессивных расстройств, поведенческих девиаций, нейровоспалительных и нейродегенеративных процессов [2; 6].
Наиболее актуальным аспектом участия цитокинов в развитии аддиктивной патологии является возможность их прямого влияния на толерантность к психоактивным веществам. Вскрыты механизмы снижения эффективности опиоидов при хронических болевых синдромах. Опиоиды стимулируют выработку провоспалительных цитокинов глиальными клетками, что приводит к повреждению нейронов, отмене аналгезии, повышению толерантности, создающему предпосылки для формирования зависимости от опиоидов [7]. Несмотря на стройность этой концепции, прямое клиническое подтверждение ее не получено. Во-первых, неоднозначным является соотношение интерлейкинов (ИЛ), продуцируемых глией и клетками крови. Во-вторых, чрезвычайно трудно дифференцировать природу воспалительных процессов при наркотической зависимости, неизбежно сопровождающейся инфекционными заболеваниями.
Имеющиеся сведения о спектре цитокинов при аддиктивной патологии весьма противоречивы, хотя большинство исследователей обращают внимание на высокий уровень провоспалительных цитокинов у аддиктов в сыворотке, сочетающийся с повышением противовоспалительного интерлейкина-10 [5; 8]. Уровень сывороточного интерферона-гамма (ИФН-γ) называется сниженным или повышенным, трактуется как следствие или причина сопутствующих вирусных заболеваний [10]. Анализ продукции интерлейкинов с позиций изменения Th1/Th2 цитокинового баланса более информативен. Ранний период опиоидной и полинаркомании характеризуется выраженной стимуляцией противовоспалительного цитокина ИЛ-10, провоспалительных цитокинов (ИЛ-1β, ИЛ-8) и высокой активностью ИФН-γ, что свидетельствует о смешанном Th1/Th2-типе иммунного ответа. В дальнейшем, в среднем через три года наркозависимости, происходит переключение на Th2-иммунный ответ, связанный с дефицитом ИФН-γ и ростом ИЛ-10 [4].
Целью нашего исследования было установление взаимосвязи между продукцией цитокинов и характеристикой этапа опиоидной зависимости – уровнем толерантности, имеющим количественное выражение.
Материалы и методы исследования
Было обследовано 46 лиц мужского пола в возрасте 22-28 лет, страдающих опийной наркоманией в течение 3-7 лет. Клиническую верификацию проводили согласно основным критериям МКБ-10 (F11.2). В качестве группы сравнения обследовано 28 условно здоровых лиц мужского пола аналогичного возраста.
Методы исследования: клинико-анамнестический, иммунологический (проточная цитометрия, культура крови, иммуноферментный анализ). Изучалась продукция фактора некроза опухолей (ФНО-α), интерлейкина-6 (ИЛ-6), интерлейкина-1β (ИЛ-1β). Основным лабораторным показателем являлось содержание цитокинов в супернатантах 48-часовых культур крови, стимулированных липополисахаридом.
Статистический анализ результатов исследования проводили с использованием пакета прикладных программ «Statistica 7.0» для Windows (StatSoft, США). Для сравнения исследуемых выборок использовали непараметрические критерии. Различия считались достоверными при уровне значимости р<0,05. Результаты представлены Median и квартильными интервалами (LQ, UQ).
При обследовании соблюдены принципы информированного согласия и конфиденциальности персональных данных.
Результаты исследования
и их обсуждение
В таблице приведены данные продукции цитокинов в обследованных группах. Как видно из таблицы, концентрации исследуемых цитокинов в группе больных опийной наркоманией отличаются от соответствующих показателей в группе здоровых лиц. При опийной наркомании продукция ИЛ-6 и ИЛ-1β достоверно превышала контрольный уровень, отмечалось снижение продукции ФНО-α, которое не достигало уровня достоверной значимости.
Таблица
Уровень цитокинов в супернатантах культур крови при опийной наркомании
|
Показатели |
Больные опийной наркоманией (n=46) |
Условно здоровые лица (n=28) |
|
ФНО-α, пг/мл |
622,5 (408,3; 895,0) |
802,4 (566,4; 982,2) |
|
ИЛ-6, пг/мл |
2974,0 (2518,2; 3746,8)* |
2320,8 (1802,6; 3420,2) |
|
ИЛ-1β, пг/мл |
245,8 (218,0; 502,4)* |
202,6 (120,5; 220,4) |
|
Примечание. * – p<0,05 между больными опийной наркоманией и условно здоровыми лицами. |
||
Поскольку повышенный уровень ИЛ-6 обычен для позднего периода зависимости от психоактивных веществ, мы сосредоточили свое внимание на возрастании продукции ИЛ-1β. Для дальнейшего анализа были выделены две группы зависимых от опиоидов лиц: с высоким (выше контрольного) – 338,4 (210,2;898,4) пг/мл (группа 1) и средним (равным контрольному) уровнем продукции данного цитокина – 210,4 (200,7;229,9) пг/мл (группа 2).
В группе 1 наблюдается тенденция к возрастанию толерантности и к снижению возраста манифестации абстинентного синдрома по сравнению с группой 2 (рисунок).
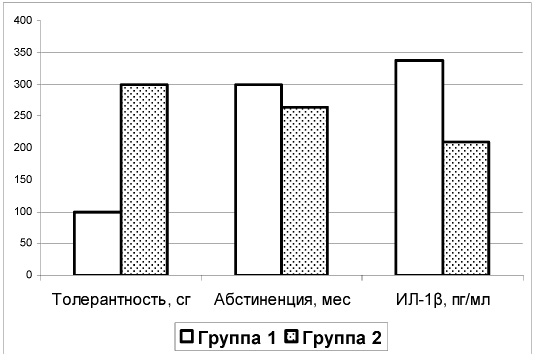
Клинико-анамнестические показатели и уровень продукции ИЛ-1β при опиоидной зависимости
Примечание. Толерантность – толерантность к опиоидам в сантиграммах; абстиненция – возраст манифестации абстинентного синдрома в месяцах
Результаты обсуждаются с учетом сведений о сопряженности регуляции иммунной и болевой чувствительности. ИЛ-1β способен оказывать влияние на ноцицепцию, вызывая как гиперальгезию, так и анальгезию в зависимости от регионарных особенностей воздействия на гипоталамус и корковые механизмы регуляции боли, дозы цитокина [9]. Выявленные нами особенности могут свидетельствовать о том, что для лиц с менее агрессивным течением опиоидной зависимости характерно увеличение уровня продукции ИЛ-1β, сочетающееся с выявленным нами ранее снижением болевой чувствительности [1; 3]. При возрастании тяжести течения синдрома зависимости от опиоидов наблюдается отсутствие изменений уровня продукции ИЛ-1β и болевой чувствительности при наличии сдвигов продукции ФНО-a и ИЛ-6.
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-15-00183).

