Ранее [1, 2] нами были разработаны поляризационные пленки на основе поливинилового спирта и ИК, поглощающие в видимой области спектра (λmax = 620 нм). Было установлено, что полученные образцы обладают высокой свето-, влагосто- и термостойкостью. Автор в [3] связывает фотостабильность молекулы ИК с конформационным затруднением процесса транс – цис изомеризации. Пространственная транс – цис – изомеризация молекулы ИК обусловлена затрудненным вращением вокруг двойной связи (–С=С–) и является причиной фотохромных изменений в целом ряде органических соединений. В силу малого отличия электронных структур исходных и конечных продуктов спектральные изменения в случае транс – цис изомеризации по сравнению с другими фотохромными процессами, как правило, менее значительны. Эти формы различаются по энергии на величину DH от 3 до 25 кДж.моль-1. В [4] авторы утверждают, что фотофизические свойства молекулы ИК связаны с присутствием центрального фрагмента молекулы – биспиррол индиго. В [5] авторы с помощью спектроскопических методов различают транс и цис производные молекулы индиго в среде разных растворителей. Изучено влияние растворителей на их спектр поглощения. Установлено, что скорость перехода транс-форма в цис-форму зависит от природы растворителя и внешних факторов (температура, концентрация).
Целью данной работы является изучение фотохромных и электронных свойств молекулы индигокармина методом DFT/B3LYP/6-311G**.
Методика проведения расчетов и обсуждение результатов
1) Расчет геометрий транс– и цис– изомеров молекулы ИК
Расчет геометрий молекул проводили поэтапно. Для нахождения стартовых структур проведена предварительная оптимизация с помощью программы HyperChem 08 методом молекулярной механики (ММ+). А затем молекулы были полностью оптимизированы методом B3LYP/6-311G** (рис. 1 а,б).
Некоторые параметры оптимизированных структур цис– и транс– изомеров ИК даны в табл. 1 и 2.
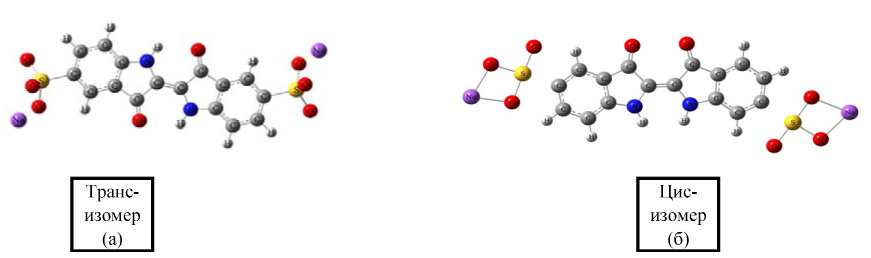
Рис. 1. Оптимизированные геометрии транс– и цис– изомерв молекулы ИК, рассчитанные неэмпирическим методом B3LYP/6-311G**
Таблица 1
Некоторые структурные параметры оптимизированного транс–изомера молекулы ИК, рассчитанные методом B3LYP/6-311G**
|
Параметры |
Рассчитанный угол, ° |
Na(30)-O(29)-S(26) |
91.29 |
|
H(38)-C(20)-C(19) |
120.73 |
Na(30)-O(28)-S(26) |
91.17 |
|
H(38)-C(20)-C(15) |
121.64 |
O(29)-S(26)-O(28) |
102.90 |
|
C(19)-C(20)-C(15) |
117.63 |
O(29)-S(26)-O(27) |
114.53 |
|
H(37)-C(19)-C(20) |
121.00 |
O(29)-S(26)-C(18) |
109.58 |
|
H(37)-C(19)-C(18) |
118.90 |
O(28)-S(26)-O(27) |
117.52 |
|
S(26)-C(18)-C(19) |
117.65 |
O(28)-S(26)-C(18) |
105.37 |
|
S(26)-C(18)-C(17) |
119.03 |
O(27)-S(26)-C(18) |
106.49 |
|
C(20)-C(15)-N(12) |
129.39 |
Параметры |
Рассчитанная длина связи, Å |
|
C(16)-C(15)-N(12) |
109.22 |
||
|
H(35)-N(12)-C(15) |
128.04 |
||
|
H(35)-N(12)-C(10) |
121.96 |
O(29)-Na(30) |
2.22 |
|
C(15)-N(12)-C(10) |
110.00 |
O(28)-Na(30) |
2.23 |
|
C(13)-C(10)-N(12) |
108.25 |
S(26)-O(29) |
1.69 |
|
N(12)-C(10)-C(9) |
125.79 |
C(18)-S(26) |
1.86 |
|
C(10)-C(9)-N(7) |
125.79 |
C(13)-O(14) |
1.26 |
|
C(8)-C(9)-N(7) |
108.25 |
N(12)-H(35) |
1.01 |
|
H(34)-N(7)-C(4) |
128.04 |
N(12)-C(15) |
1.39 |
|
C(9)-N(7)-C(4) |
110.00 |
C(10)-N(12) |
1.39 |
|
N(7)-C(4)-C(5) |
109.22 |
C(8)-O(11) |
1.26 |
|
N(7)-C(4)-C(3) |
129.39 |
N(7)-H(34) |
1.01 |
|
S(21)-C(1)-C(6) |
119.04 |
N(7)-C(9) |
1.39 |
|
S(21)-C(1)-C(2) |
117.65 |
C(4)-N(7) |
1.39 |
|
O(29)-Na(30)-O(28) |
72.71 |
C(1)-S(21) |
1.86 |
Таблица 2
Некоторые структурные параметры оптимизированного цис– изомера молекулы ИК, рассчитанные методом B3LYP/6-311G**
|
Параметры |
Рассчитанный угол, ° |
C(9)-N(8)-C(4) |
111.57 |
|
O(29)-Na(30)-O(28) |
69.42 |
O(11)-C(7)-C(9) |
128.14 |
|
Na(30)-O(29)-S(26) |
100.62 |
O(11)-C(7)-C(5) |
127.03 |
|
Na(30)-O(28)-S(26) |
100.20 |
N(8)-C(4)-C(5) |
108.90 |
|
O(29)-S(26)-O(28) |
89.76 |
N(8)-C(4)-C(3) |
129.82 |
|
O(29)-S(26)-O(27) |
92.34 |
H(32)-C(3)-C(4) |
121.98 |
|
O(28)-S(26)-O(27) |
177.90 |
H(32)-C(3)-C(2) |
120.33 |
|
O(24)-Na(25)-O(23) |
69.84 |
H(31)-C(2)-C(3) |
121.12 |
|
Na(25)-O(24)-S(21) |
100.61 |
Параметры |
Рассчитанная длина связи, Å |
|
Na(25)-O(23)-S(21) |
100.02 |
||
|
O(24)-S(21)-O(23) |
89.52 |
||
|
O(24)-S(21)-O(22) |
92.27 |
O(29)-Na(30) |
2.17 |
|
O(23)-S(21)-O(22) |
178.21 |
S(26)-O(29) |
1.75 |
|
C(17)-C(16)-N(13) |
129.07 |
S(26)-O(28) |
1.75 |
|
C(15)-C(16)-N(13) |
108.87 |
S(26)-O(27) |
1.68 |
|
C(16)-N(13)-C(10) |
111.43 |
O(24)-Na(25) |
2.16 |
|
C(15)-C(12)-O(14) |
126.69 |
S(21)-O(24) |
1.75 |
|
O(14)-C(12)-C(10) |
128.41 |
N(13)-H(35) |
1.00 |
|
N(13)-C(10)-C(12) |
106.18 |
N(13)-C(16) |
1.40 |
|
N(13)-C(10)-C(9) |
123.34 |
C(10)-N(13) |
1.40 |
|
C(10)-C(9)-N(8) |
123.15 |
N(8)-H(34) |
1.00 |
|
N(8)-C(9)-C(7) |
106.13 |
C(7)-O(11) |
1.24 |
|
H(34)-N(8)-C(9) |
125.45 |
C(6)-H(33) |
1.08 |
|
H(34)-N(8)-C(4) |
123.00 |
C(4)-N(8) |
1.3954 |
2) Расчет электронных структур и полных энергий транс– и цис– изомеров ИК
Теоретический спектр поглощения оптимизированных транс– и цис– изомеров молекулы ИК в водной среде был рассчитан с помощью программного пакета Gaussian 09W, используя уровень теории TDB3LYP/6-311G**. Для учета воды была использована модель поляризационного континуума Томаси (PCM). В исследуемой области (250-900 нм) для транс– изомера были найдены три пика поглощения с максимумами при 320, 374 и 609 нм
(табл. 3).
Таблица 3
Рассчитанный электронный спектр транс–изомера молекулы ИК
|
Длина волны, нм |
Разложение волновых функций по однократно возбужденной конфигурации |
Сила осциллятора (f) |
|
609 |
0.70 (118→119) – 0.12 (119→118) |
0.37 |
|
374 |
0.18 (111→119) + 0.67 (114→119) |
0.06 |
|
320 |
- 0.10 (102→119) + 0.67 (105→119) – 0.16 (118→123) |
0.15 |
Полоса поглощения при λmax = 609 нм и силе осциллятора f = 0.37 относится к переходу молекулы в возбужденное синглетное состояние (S1). Расчеты показывают, что данное возбужденное состояние описывается волновой функцией, состоящей из двух конфигураций для одноэлектронных возбуждений (118→119 и 119→118). Возбуждение электрона с 118 молекулярной орбитали (МО) на 119 МО дает главный вклад в формировании полосы поглощения в видимой области спектра при 609 нм (рис. 2).

Рис. 2. Виды МО, принимающих участие в формировании спектра поглощения транс–изомера
при 320, 374 и 609 нм
В данной области (250-900 нм) для цис– изомера были найдены три пика поглощения с максимумами при 477, 560 и 773 нм
(табл. 4).
Таблица 4
Рассчитанный электронный спектр цис–изомера молекулы ИК
|
Длина волны, нм |
Разложение волновых функций по однократно возбужденной конфигурации |
Сила осциллятора (f) |
|
773 |
0.68 (118→120) |
0.09 |
|
560 |
0.15 (109→119) + 0.57 (114→121) + 0.31 (115→119) |
0.18 |
|
477 |
0.22 (111→123) + 0.38 (112→120) + 0.14 (113→123) – 0.22 (115→120) – 0.38 (118→122) |
0.35 |
Полоса поглощения при λmax = 477 нм и силе осциллятора f = 0.35 относится к переходу молекулы в возбужденное синглетное состояние (S1). Данное возбужденное состояние описывается волновой функцией, состоящей из пяти конфигураций для одноэлектронных возбуждений (111→123, 112→120, 113→123, 115→120 и 118→122) (рис. 3).
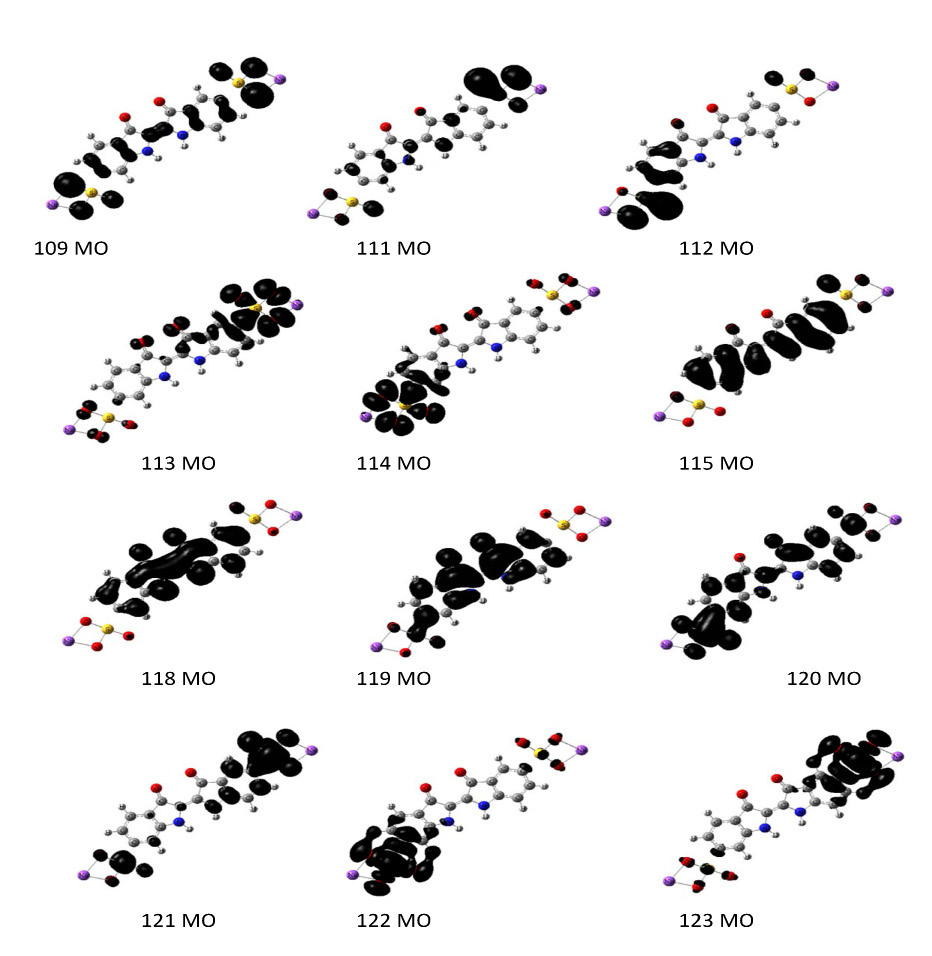
Рис. 3. Виды МО, принимающих участие в формировании спектра поглощения цис–изомера
при 477, 560 и 773 нм
Расчет полных энергий Хартри транс– и цис– изомеров (Ет = – 2446.1307835
и Ец = – 2445.8669037) с одной стороны свидетельствует об энергетической выгодности и устойчивости транс– изомера, а с другой – о высокой скорости превращения транс– изомера в цис– изомер
(∆Е = 0.2638798 Хартри). Время данного перехода в молекуле ИК составляет несколько пикосекунд [6].
3) Расчет электрических свойств транс– и цис– изомеров ИК
Вид и энергия граничных молекулярных орбиталей играют важную роль в проявлении электронных и оптических свойств молекул, а также являются показателем их химической активности [7]. Разница между значениями энергий ВЗМО и НВМО служит критерием переноса заряда внутри молекулы. Расчеты показывают, что данные значения для транс– и цис– изомеров составляют: ВЗМОт – НВМОт = – 0.21645 + +0.12587 = – 0.09058 эВ и ВЗМОц –
– НВМОц = – 0.19827 + 0.13816 =
= –0.06011 эВ соответственно. С другой стороны разница между значениями ВЗМО и НВМО свидетельствует о ширине запрещенной зоны молекулы ИК. Транс-изомер с энергией 0.09058 эВ по сравнению с цис– изомером (0.06011 эВ) является более сильным полупроводником.
Выводы
Неэмпирическим методом B3LYP/6-311G** рассчитаны структурные параметры оптимизированных цис- и транс-изомеров молекулы индигокармина.
Найдено, что фотохромные свойства индигокармина обусловлены переходом транс– изомера в цис– измер. Для транс– изомера полоса поглощения при
λmax = 609 нм и силе осциллятора f = 0.37 относится к переходу молекулы в возбужденное синглетное состояние (S1), однако для цис-изомера при λmax = 477 нм и силе осциллятора f = 0.35 происходит переход молекулы в возбужденное синглетное состояние (S1). При переходе от транс-изомера к цис-изомеру наблюдается гипсохроный сдиг полосы поглощения на 132 нм.
Установлено, что транс-изомер с энергией 0.09058 эВ по сравнению с цис– изомером (0.06011 эВ) является более сильным полупроводником.

