В настоящее время в различных отраслях промышленности и науки используют множество наноразмерных искусственно созданных материалов, в том числе, и наноразмерные алмазы (НА) [7, 8]. В медицине одним из важнейших свойств наноматериалов для их широкого использования в фармации и медицинской практике как с позиции биобезопасности, так и сопряженной с нею вероятности проявлений различного рода эффектов, являются их биосовместимость и биотропность [2, 3, 6]. Проблема биотропности сопряжена с механизмами интернализации изучаемых объектов корпускулярной природы, но интернализация НА частиц в литературе оснащены недостаточно хорошо, имея ввиду их разнообразие и клеток-акцепторов [5, 7]. Ряд исследований показывают различия в способах захвата корпускулярных объектов в зависимости от их размера, химической структуры и электрохимического заряда, а также типа клеток [1, 9, 10]. Имеющиеся в научной литературе данные, касающиеся механизмов эндоцитоза НА частиц МФ фрагментарны и не достаточны для прогнозирования биологических эффектов, оказываемых НА частицами, в частности, на МФ.
В этой связи целью настоящего исследования было изучение биотропности, закономерностей и механизмов захвата частиц наноразмерных алмазов марки «УДА-В-ГО» макрофагами in vitro.
Материалы и методы исследования
Эксперименты были выполнены in vitro на макрофагах из перитонеального транссудата мышей-самцов линии BALB/c 2-х месячного возраста, с массой тела 21–22 гр., полученных из питомника ФГБНУ «НИИ клинической иммунологии» (г. Новосибирск, Россия). Перитонеальные макрофаги (МФ) получали после выведения животных из эксперимента путем дислокации позвонков в шейном отделе под легким эфирным наркозом. Предварительно клетки из перитонеального транссудата эксплантировали в культуру и культивировали при 37°C, в течение 3-х часов на покровных стеклах для прикрепления МФ (106 клеток в 1,5 мл среды 199, содержащей 10 % сыворотки эмбрионов коров). Через 3 часа неадгезированные клетки смывали средой для культивирования. Полученные первичные культуры МФ культивировали в течение 24 часов с целью их адаптации.
Наноалмазы (НА) марки «УДА-В-ГО» были любезно предоставлены ОАО ФНПЦ «Алтай», Россия. В исследовании использовали искусственно полученные НА в диапазоне размеров 4–6 нм. Исследование вероятных биоактивных свойств НА в отношении перитонеальных МФ проводили через 24 и 48 часов после внесения НА в первичные 24-часовые культуры МФ. В среду для культивирования вносили 1,6 % стерильную суспензию НА в бидистиллированной воде до конечной концентрации 20 мкг/мл. После этого суспензию тщательно перемешивали и обрабатывали ультразвуком при помощи ультразвукового дезинтегратора МУЗА-0,1/22-М в течение 10 сек при мощности 75 Вт для разрушения вероятных агрегатов НА. Внесение в культуру НА осуществляли путем замены изначальной среды культивирования на среду, содержащую НА в соответствующей концентрации. Контролем служили МФ, в среду для культивирования которым через 24 часа культивирования вносили свежую среду культивирования взамен предыдущей, в нее предварительно вносили бидистиллированную стерильную воду в объеме, идентичном тому, что получали МФ в суспензии с НА.
Светооптическое исследование МФ в культурах проводили с помощью микроскопа «AxioImager Z1» (Zeiss, Германия) в режиме светлого поля, фазового интерференционного контраста и флуоресцентной микроскопии. Препараты клеточных культур фотографировали при помощи цифровой камеры «AxioCam HRc» (Zeiss, Германия). Для анализа накопления НА в МФ был проведен морфометрический анализ микрофотографий агрегатов исследуемых НА частиц при исследовании их в проходящем свете и флуоресцентном освещении. Анализ яркостных характеристик НА и их агрегатов на полученных цифровых фотографиях проводили при помощи программы «ВидеоТест Морфо 3.2» (г. Санкт-Петербург). Для выявления НА в МФ было использовано комбинированное освещение препаратов – одновременно в проходящем свете при установленном зеленом светофильтре и индуцированной флуоресценции МФ (дополнительно окрашенных акридиновым оранжевым), в «зеленой» области флуоресценции (при установке узкополосного светофильтра, предназначенного для исследования ФИТЦ-флуоресценции).
Методы электронно-микроскопического исследования биотропности макрофагов, подвергнутых воздействию наноразмерных алмазных частиц. Образцы клеточных культур для электронной микроскопии фиксировали 2,5 % раствором глютарового альдегида в 0,1 М какодилатном буфере, дальнейшую обработку образцов проводили по методикам, описанным ранее [4]. Микрофотографии были получены на трансмиссионном электронном микроскопе «JEM 1400» (JEOL, Япо-ния) при ускоряющем напряжении 80 кВ. Для анализа захвата и интернализации НА частиц МФ проводили визуальный анализ полученных изображений для разных временных точек инкубации МФ с наночастицами и сопоставляли с изображениями, полученными в контроле.
Полученные данные были статистически обработаны с помощью лицензированных пакетов прикладных программ «Statistica v.6» и «Excel v.7». Вычисляли среднюю величину (M) и стандартную ошибку среднего (SE или m). Данные представлены в виде M ± m. Вероятность достоверности различий между сравниваемыми средними величинами исследованных показателей в экспериментальных группах культур оценивали с помощью непараметрического критерия Манна-Уитни. Различия считали достоверными при величине вероятности принятия нулевой гипотезы о принадлежности сравниваемых независимых выборок к одной и той же генеральной совокупности (H0) с вероятностью p < 0,05.
Результаты исследования и их обсуждение
На первом этапе исследования эндоцитозной активности МФ в отношении НА использовали метод фазового интерференционного контраста при обычном освещении и метод фазового контраста в поляризованном свете. При исследовании культуры МФ методом фазового контраста при обычном освещении выявляемые вакуоли выглядели как достаточно однородные оптически плотные структуры. Выявляемые вакуоли были гетерогенны по размерам и занимали значительную часть цитоплазмы МФ. При помощи метода фазово-контрастной микроскопии в поляризованном свете было показано, что исследуемые вакуоли МФ гетерогенны по оптической плотности даже в переделах отдельных вакуолей, что свидетельствовало о наличии в них частиц НА. Однако указанные методы не позволяли морфометрически оценить количество НА, накапливающихся в МФ, поскольку метод фазовоконтрастной микроскопии «высвечивает» все оптически разнородные клеточные структуры. Для анализа накопления НА в МФ было проведено исследовании культур МФ при комбинированном освещении – проходящем свете и флуоресцентном освещении (рис. 1), при котором накопившиеся в МФ частицы НА выглядели значительно темнее (5–10 единиц по международной шкале градаций серого цвета, оцениваемого в диапазоне 0–255), чем стеклянная подложка (235–250).
При таком способе анализа МФ было отчетливо видно, что эндоцитозные вакуоли содержат оптически плотный материал, соответствующей оптической яркости НА в проходящем свете – 5–10 единиц (рис. 1). Большинство эндосом при сходной оптической яркости значительно варьировало по величине, что косвенно указывало на то, что образование крупных фагосом может происходить в результате слияния более мелких эндосом, содержащих НА.
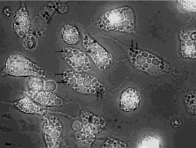
Рис. 1. Культура перитонеальных макрофагов, через 24 часа после внесения в нее частиц НА в концентрации 20 мкг/мл. Метод комбинированного освещения препаратов – в проходящем свете при установленной зеленом светофильтре и индуцированной флуоресценции клеток, окрашенных акридиновым оранжевым (эндоцитозные вакуоли с различной плотностью накопления в них НА обозначены стрелками). Увеличение 1000
Установлено, что количество НА частиц в МФ возрастает с увеличением времени инкубирования МФ с НА частицами (рис. 2). При этом выявлено, что количество НА частиц в МФ достигает некоторого максимума к 24 часу культивирования. Эти данные косвенно указывают на то, что через 24 часа культивирования в среде, содержащей НА частицы, вакуолярный аппарат МФ, по-видимому, полностью «насыщается» НА, что сопряжено со снижением их эндоцитозной активности в отношении к НА к этому времени.

Рис. 2. Результаты исследования эндоцитоза частиц НА макрофагами в культуре в зависимости от времени культивирования (при концентрации НА 20 мкг/мл). Примечание. Вероятность достоверности различий (P) между сравниваемыми средними величинами исследованных показателей: ** P < 0,01
Для исследования захвата и интернализации НА частиц в биосовместимой концентрации (20 мкг/мл) МФ исследовали в трансмиссионном электронном микроскопе. Через 1 сутки после внесения НА в культуры МФ эндосомы, содержащие НА, отмечали преимущественно в зонах, прилегающих к плазмолемме МФ (рис. 3). Размеры эндосом (их диаметры) варьировали от 0,1 до 0,3 мкм. При этом в эндосомах НА располагались в виде агрегатов в наноразмерном диапазоне 25–50 нм. Наряду с эндосомами в МФ выявлялись вторичные лизосомы, содержащие частицы НА. В плазмалемме МФ наблюдали образование большого количества цитоплазматических выростов.
В случаях, когда ядро располагалось достаточно близко к плазмолемме, эндосомы с НА выявляли в перинуклеарных зонах МФ. Плотность содержания НА в фагоцитозных вакуолях, количество частиц НА в эндосомах и размеры эндосом – все эти показатели эндоцитозной активности МФ сильно варьировали по величине. Например, размеры эндосом варьировали в диапазоне 0,3–1,0 мкм, а количество НА в усл. ед. (площади, занимаемой наночастицами, в мкм2) в пересчете на одну эндосому варьировали от 0,04 до 0,09 мкм2. Также через 24 и 48 часов инкубации МФ с НА частицами были обнаружены единичные НА в цитозоле МФ.
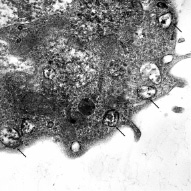
Рис. 3. Часть цитоплазмы макрофага через 1 сутки после внесения в культуру частиц НА в концентрации 20 мкг/мл. Формирование крупных эндосом, содержащих НА в зонах, прилегающих к плазмолемме МФ (обозначены стрелками). Увеличение 10000
Наряду с формированием типичных фагоцитозных эндосом, содержащих частицы НА, в МФ, культивируемых в среде с НА, отмечали в достаточно большом количестве эндосомы клатринового типа с размерами эндосом 100 нм (рис. 4). Некоторые клатриновые везикулы находились вблизи крупных эндосом, что может свидетельствовать о высокой вероятности их последующего слияния с ними. Таким образом, накопление НА в МФ могло осуществляться, вероятно, в результате работы трех механизмов: в результате активного пиноцитоза питательной среды, содержащей отдельные НА и их небольшие агрегаты НА (50–100 нм); эндоцитоза крупных агрегатов НА (более 100 нм); эндоцитоза с формированием клатриновых эндоцитозных везикул с НА (в размерном диапазоне 5–10 нм). Отмечена высокая активность плазмалеммы, характеризующаяся образованием большого количества цитоплазматических выростов. При этом плазмалемма имела сложную конфигурацию с формированием смыкающихся друг с другом цитоплазматических выростов, формирующих эндоцитозные вакуоли.
Через 2 сутки после внесения НА в культуры МФ эндосомы, содержащие НА, наблюдали достаточно равномерно по всей цитоплазме, от зоны, прилегающей к плазмолемме МФ до перинуклеарной зоны (рис. 5).
Размеры эндосом варьировали в диаметре от 0,5 до 0,9 мкм. В эндосомах НА располагались в виде плотных агрегатов в наноразмерном диапазоне 50–100 нм. Наряду с типичными эндосомами, содержащими НА, в МФ выявляли крупные вакуоли, содержащие частицы НА, с менее плотной их «упаковкой» и характерной компартментализаций, что свидетельствовало, о том, что такие эндоцитозные вакуоли могли образовываться в результате слияния более мелких эндосом.
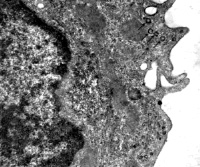
Рис. 4. Часть цитоплазмы макрофага через 2 суток после внесения в культуру частиц НА в концентрации 20 мкг/мл. Формирование смыкающихся друг с другом цитоплазматических выростов плазмалеммы, формирующих крупные эндоцитозные вакуоли. Формирование клатриновых везикул, содержащих частицы НА (обозначены стрелками). Увеличение 10000

Рис. 5. Макрофаг из культуры перитонеальных макрофагов мышей через 2 суток после внесения в культуру частиц НА в концентрации 20 мкг/мл. Эндосомы, содержащие НА, располагаются равномерно по всей цитоплазме (обозначены стрелками), от зоны, прилегающей к плазмолемме макрофага до перинуклеарной зоны. Увеличение 5000
Заключение
Таким образом, по данным электронно-микроскопического анализа МФ, «сокультивированных» с НА частицами в концентрации 20 мкг/мл в культуральной среде, можно сделать заключение, что исследованные НА марки «УДА-В-ГО» обладают тропностью к структурам вакуолярного аппарата МФ. Захват НА осуществлялся тремя механизмами: в результате активного пиноцитоза питательной среды, содержащей отдельные НА и их небольшие агрегаты НА (50-100 нм); эндоцитоза крупных агрегатов НА (более 100 нм); эндоцитоза с формированием клатриновых эндоцитозных везикул с НА (в размерном диапазоне 5–10 нм).

