В настоящее время значительно возрос интерес к лекарственным средствам растительного происхождения в связи с их более мягким по сравнению с синтетическими препаратами действием и меньшими побочными эффектами [6]. Для расширения сырьевой базы лекарственного и пищевого растительного сырья в последние годы стали использоваться относительно малоисследованные объекты, к которым относятся лишайники, насчитывающих на территории Якутии свыше 600 видов. Лишайники рода Cladonia давно применяются в традиционной медицине. Известны их антиоксидантные, антимикробные и детоксикационные свойства [2–4].
Лишайники синтезируют большое число органических соединений, многие из которых не найдены ни в одном другом виде живых организмов, в том числе аминокислоты и их производные, алифатические кислоты, каротиноиды, ароматические соединения, хиноны, ксантоны, депсиды, терпеноиды и стероиды. В составе лишайников найдены линейные, разветвленные и алициклические алканы, линейные насыщенные и ненасыщенные кислоты, гидроксикислоты, серия производных моно-, ди- и трикарбоновых кислот и много других представителей органической химии [5].
Целью исследования является определение летучих компонентов лишайникового сырья методом газовой хроматографии.
Материалы и методы исследования
Объектом исследования является механоактивированный порошок ягеля, используемый как сырье для производства биологически активной добавки к пище (БАД). Материал для изучения получили путем механохимической активации в воздушной среде в мельнице-активаторе проточного типа ЦЭМ 7–80 сухих слоевищ лишайников, включающей протекание твердофазных механохимических реакций без участия растворителей в одну технологическую стадию [1].
В исследовании использовали газовый хроматомасс-спектрометр GCMS-2010 Ultra фирмы Shimadzu (Япония). Разделение проводили на колонке ZB-5 MS 30м×0,25 мм, с использованием градиентного режима нагрева: 0–2 мин – 40 °С, 2–28 мин 40–300 °С, 28–34 мин – 300 °С. Сканирование проводили в диапазоне m/z 15–400 Да. Температура инжектора – 250 °С, температура источника ионизации – 250 °С, температура интерфейса – 250 °С, напряжение на детекторе – 400 еВ. Пробоподготовка заключалась в приготовлении трех различных экстрактов тремя растворителями – метиловым спиртом, этилацетатом и дихлорметаном. Ввод пробы осуществляли в двух режимах: ввод 0.5 мл нагретого (80 °С, 10 мин) пара над образцом порошка лишайника с добавкой 1 мл метанола и 1 мкл жидких экстрактов CH2Cl2, EtOAc и MeOH из этого порошка, разбавленных в 100 раз в CH2Cl2.
Результаты исследования и их обсуждение
В экстракте EtOAc было обнаружено сравнительно меньшее число летучих компонентов (около 20) (рис. 1).
Из них характерными для исследуемого образца являются предельные кислоты и их эфиры. Экстракция CH2Cl2 и MeOH позволяет выделить намного больше (около 100) летучих компонентов из исследуемого объекта (рис. 2, 3).
Основными компонентами CH2Cl2 и MeOH экстрактов являются предельные углеводороды и спирты. Кроме того в CH2Cl2 обнаружен ароматический спирт – 2,4-диизобутил-фенола (рис. 4).
Чтобы убедиться в том, что в исследуемом объекте в больших количествах отсутствуют летучие компоненты, образец порошка лишайника и 1 мл метанола поместили в стеклянную пробирку на 15 мл для нагревания и перемешивания, с последующим отбором 0,5 мл нагретого пара над веществом. Полученная хроматограмма представлена на рис. 5.
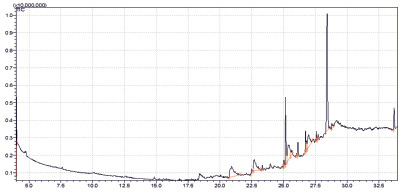
Рис. 1. Хроматограмма образца экстракта EtOAc. Объем вводимой пробы – 1 мкл
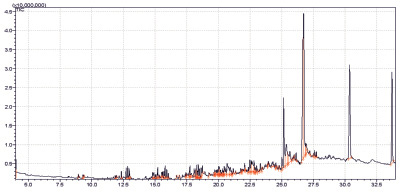
Рис. 2. Хроматограмма образца экстракта CH2Cl2. Объем вводимой пробы – 1 мкл
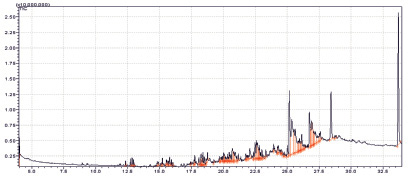
Рис. 3. Хроматограмма образца экстракта MeOH. Объем вводимой пробы – 1 мкл
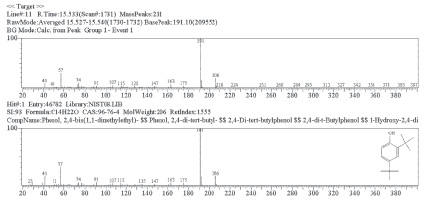
Рис. 4. Идентификация масс-спектра пика 11 из экстракта MeOH. Параметр совпадения с базой около 95 %
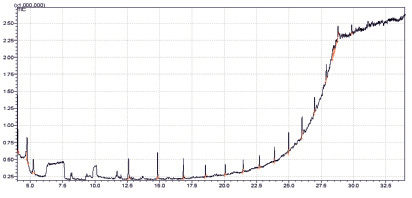
Рис. 5. Хроматограмма образца при парофазном вводе пробы. Объем вводимой пробы – 0,5 мл
Помимо системных сигналов от неподвижной фазы колонки на хроматограмме присутствовали небольшие количества 2,3-диметилгепт-1-ена.
Следует отметить, что содержание обнаруженных компонентов в экстрактах из растительного образца и при парофазном вводе пробы сравнительно не велико, и возникновение этих веществ может быть обусловлено частичным термическим разложением нелетучих компонентов пробы. Помимо системных пиков на хроматограммах отсутствуют интенсивные пики средне и слабополярных летучих соединений. Хроматографические профили исследованных экстрактов типичны для растительных объектов, однако следует отметить отсутствие летучих производных фурана, что косвенно свидетельствует об отсутствии в образце больших количеств моно- и дизамещенных сахаридными остатками органических компонентов.
Заключение
Исследованный образец лишайникового сырья не содержит больших количеств среднелетучих органических соединений сложной структуры, таких как, незамещенные сапонины и сесквитерпены.
Определение летучих соединений методом газовой хроматографии зависит от вида экстрагена, большее число компонентов (свыше 100) обнаружено в экстрактах с метанолом и с хлористым метиленом и сравнительно меньше – в экстракте с этанолом (около 20).
Перспективы исследования химического состава образца принадлежат методам жидкостной хроматографии, позволяющей идентифицировать и определять нелетучие физиологически активные компоненты.

