Направление использования стволовых клеток в кардиологии интенсивно разрабатывается в последние 5-10 лет благодаря тому, что в 1999 году появились работы, в которых описывается культивирование кардиомиоцитов (КМЦ) из мезенхимальных стволовых клеток костного мозга (МСК) [8,9]. В результате экспериментальных работ было доказано, что МСК костного мозга человека обладают способностью усиливать перфузию ишемизированных участков миокарда. Однако является ли этот эффект прямым действием МСК или опосредованным, через продукцию цитокинов и ростовых факторов – остается спорным.
Концепция регенеративной медицины, базирующаяся на использовании собственных стволовых клеток для восстановления поврежденных тканей, сосудов и органов, в последние годы широко внедряется в практическую медицину [1]. Клеточная терапия на основе стволовых клеток (СК) является одним из наиболее перспективных и инновационных направлений развития медицины и уже сегодня позволяет получить качественно новые клинические результаты в различных областях [2,6].
Стремление восполнить недостаток сократительных элементов в поврежденном миокарде кажется очевидным направлением лечения сердечной недостаточности. Неудивительно, что первые исследования возможностей клеточной терапии были посвящены трансплантации в миокард клеток, способных к сокращению: кардиомиоцитов, скелетных миобластов, гладкомышечных клеток [7]. В дальнейшем произошел эволюционный пересмотр используемых культур клеток при сердечной патологии и был внедрен термин «клеточная кардиомиопластика» призванный изменить процессы структурно-функциональной перестройки миокарда (ремоделирование сердца) и в конечном счете улучшить его функцию [3].
Одним из наиболее обсуждаемых направлений клеточной кардиомиопластики сегодня является пересадка собственных стволовых клеток костного мозга. Будучи мультипотентными, постнатальные СК составляют существенный восстановительный резерв в организме и способствуют замедлению развития дефектов, возникающих в силу тех или иных обстоятельств. За счет неоваскулогенеза, уменьшения площади рубца, повышения фракции выброса и формирования резистивности к стресс-нагрузке в эксперименте, было решено улучшить сократительную способность сердца при остром инфаркте миокарда путем трансплантации клеточных культур изогенных доноров.
Цель исследования. Изучить хронотропную функцию сердца при экспериментальном инфаркте миокарда, а так же динамику ЧСС на проведение стресс-теста изопропилнорадреналином после терапевтической кардиомиопластики мультипотентными мезенхимальными стволовыми клетками.
Материалы и методы исследования
В эксперименте использовались самки крыс линии Вистар-Кайото в количестве 90 особей, которые были разделены на 3 группы и 7 самцов: I группа – контрольная – интактные животные которым не проводилось каких-либо манипуляций (n=30) ; II группа – животные, которым моделировался ИМ, но никакого терапевтического воздействия не проводилось (n=30); III – животные, которым на фоне ИМ выполняли трансплантацию ММСК (n=30); Кроме этого 7 здоровых крыс самцов были донорами стволовых клеток. Выполняли изогенную трансплантацию клеток у инбредных животных характеризующихся высокой степенью гомозиготности по большинству генов, что в определенной степени нивелировало отторжение клеточного трансплантата и приближало эксперимент к условиям аутотрансплантации, как наиболее перспективного метода в клинической практике. для получения культуры мезенхимальных стволовых клеток мы использовали костный мозг здоровых животных крыс-самцов, для того чтобы потом по реакциии гибридизации с Y-хромосомой индентифицировать трансплантат в организме реципиента. Клеточную кардиомиопластику осуществляли непосредственно после моделирования ИМ. Выделяли бедренную вену, пунктировали и вводили трансплантат. После выполнения манипуляции иглу извлекали из просвета бедренной вены, кровотечение останавливали путем прижатия выходного отверстия в течении 2 минут.
Всем животным входящих в исследования моделировали ИМ по классической методике [4,5]. Оперативные вмешательства проводили в условиях общего обезболивания, путем интраперитонеального введения калипсола и ксилазина в дозах 60 мг/кг и 7,5 мг/кг соответственно. Выполняли левостороннюю торакотомию в 5 межреберье, продольно вскрывали перикард. Инфаркт моделировали путем прошивания передней левожелудочковой артерии на уроне нижнего ушка левого предсердия, после первого деления, нитью Prolene 7/0 (фирмы Ethicon, Inc.).
Исследование электрической активности миокарда крысы и показателей ЧСС производилось в условиях медикаментозного сна, животных фиксировали в положении на спине. Выполняли электрокардиографию в стандартном I отведении с помощью ЭКГ аппарата ЭК01Т. Импульс 1 мВ, амплитуда 20 мм, скорость протяжки ленты 50 мм/с. Стресс нагрузку моделировали внутримышечным введением изопропилнорадреналина в дозе 3 мкг/кг, после чего регестрировали ЧСС каждые 3 минуты на протяжении последующего четверти часа. Таким образом у нас был 5 контрольных точек изучения реакции сердца на стресс-имитирующие условия.
По окончании измерений электроды кардиографа извлекали, возможные повреждения кожных покровов обрабатывали антисептиком. для выхода из наркоза животное помещали в теплое, сухое помещение со свободным доступом к воде.
Эксперимент на животных и клиническая часть выполнялись при строгом соблюдении международных правил биоэтики, предложенных международными организациями и ассоциациями, протокол экспериментального и клинического исследования был одобрен локальным этическим комитетом (протокол № 2 от 06.06.2014г.). Он соответствует Хельсинской декларации Всемирной медицинской ассоциации 2010 г. просмотра.
Статистическую обработку выполняли с помощью пакета программ Statіstіca 6.0 фирмы StatSoft (USA).
Результаты исследования и их обсуждение
У интактных животных ЧСС в стандартных условиях составляла 485 ± 43 уд/мин. При моделировании поражения миокарда этот показатель снижался до 142,5 ± 78,9 уд/мин. А уже через два часа соответствовал 270 ± 100,25 уд/мин (рис. 1.). Через неделю, у группы животных с ИМ аналогичный показатель деятельности сердечно – сосудистой системы был значительно выше – 541 ± 19 уд/мин. Тогда как исследования базового уровня ЧСС через две недели статистически достоверных (p < 0,05) различий с показателями интактных животных не выявили – 503 ± 23 уд/мин (рис. 2.).
В наших исследованиях, экспериментальный ИМ был сопряжен с выраженным снижением сократительной функции сердца. Тенденция к восстановлению, впрочем, наметилась уже в первые часы после указанной операции, что позволяет предположить наличие мощных компенсаторных механизмов, как в самом миокарде, так и в сердечно – сосудистой системе в целом. Это положение подтверждается, на наш взгляд, реакцией сердца на стрессовую нагрузку.
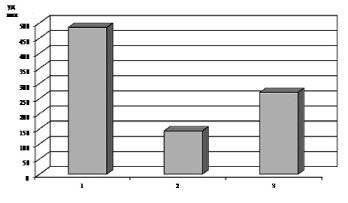
Рис. 1. Изменения частоты сердечных сокращений у животных при моделировании инфаркта миокарда: 1 – частота сердечных сокращений у животных до моделирования инфаркта миокарда; 2 – частота сердечных сокращений у животных при моделировании инфаркта миокарда; 3 – частота сердечных сокращений у животных через два часа после моделирования инфаркта миокарда
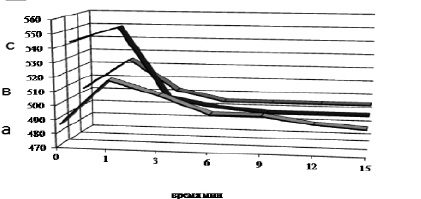
Рис. 2. Динамика изменений частоты сердечных сокращений у экспериментальных животных при моделировании стрессовой нагрузки: А – интактные животные; В – животные через 14 дней после моделирования инфаркта миокарда; С – животные через 7 дней после моделирования инфаркта миокарда
В начале наблюдений, до введения изопропилнорадреналина, на 14 день эксперимента, базовые значения ЧСС существенно различались у всех групп животных. Так в первой группе этот показатель составил 485±43 уд/мин. У крыс после моделирования инфаркта миокарда отмечались более высокие значения – 503±23 уд/мин (р≥0,05). Введение мезенхимальных стволовых клеток животным с моделью инфаркта миокарда приводило к снижению базовых значений ЧСС до 489±14 уд/мин (р≥0,05). Стресс – имитирующая нагрузка изопропилнорадреналином проявлялась в положительном хронотропном эффекте у всех групп животных. для интактных крыс максимальные значения ЧСС составили 517±35 уд/мин (р≤0,05). У крыс после моделирования инфаркта миокарда отмечались более высокие значения – 525±15 уд/мин (р≤0,05). У животных с моделью инфаркта миокарда после введения мезенхимальных стволовых клеток стрессовая нагрузка сопровождалась увеличением ЧСС до 528±9 уд/мин (р≤0,05). К окончанию наблюдения (после 15 минут) у всех групп животных отмечалось снижение ЧСС, при этом его выраженность была различна. Так, у интактных крыс величина ЧСС составила 490±23 уд/мин (р≤0,05). У крыс после моделирования инфаркта миокарда значения оставались более высокими – 495±15 уд/мин (р≥0,05). У животных после введение мезенхимальных стволовых клеток конечные значения ЧСС составили 503±15 уд/мин (р≥0,05).
В целом, анализируя полученные данные, необходимо отметить, что развитие реакции на введение изопропилнорадреналина у интактных животных характеризуется двумя фазами – быстрым, в течении одной – трех минут, увеличением ЧСС и её медленной стабилизацией с последующим снижением до окончания наблюдения. Как правило, у здоровых животных, значения ЧСС, наблюдаемые к окончанию эксперимента несколько выше базовых. Иная тенденция прослеживается у животных с моделью инфаркта миокарда. У них конечные значения ЧСС ниже базовых, что по-нашему мнению, связано с нестабильной деятельностью сердца.
Выводы
В наших исследованиях, использование мезенхимальных стволовых клеток способствовало восстановлению реакции сердца на стресс, проявлявшееся в нормализации как хронотропного ответа на введение изопропилнорадреналина, так и времени стабилизации этого показателя. Данный факт подтверждает теорию о регенераторных способностях миокарда и стимуляции неоваскулогенеза за счет непосредственного участия МСК в ангиогенезе, а также паракринного эффекта, что существенно улучшает адаптационные способности сердца в постинфарктном периоде.

