В последнее время особый интерес представляют наноматериалы из наноструктурированных частиц диоксида кремния (SiO2-нч) в виде аморфной (кремнезем) и кристаллической (кварц) модификации [2, 4-9]. Форма частиц близка к сферической, а размер с учетом условий получения варьирует от 5 до 80 нм. При попадании в организм SiO2-нч они биодеградируют в почках до орто-кремниевой кислоты и выводятся с мочой [9]. Поэтому SiO2-нч рассматриваются как перспективный, биосовместимый и биодеградируемый материал способный проникать в внутрь клетки, для разработки на его основе лекарственных препаратов и диагностических средств [2].
С другой стороны, достижения в клеточных технологиях позволили в последнее время получать в достаточном количестве аутологичные мультипотентные мезенхимальные стволовые клетки (ММСК). ММСК обладают противовоспалительной активностью, способны стимулировать процессы неоангиогенеза в зоне ишемии органов и тканей, способны к цитодифференцировке в адипогенном, остеогенном, хондрогенном и миогенном направлениях, а функциональная активность ММСК регулируется различными факторами внешней и внутренней среды [3].
В тоже время, нет единого мнения о токсичности SiO2-нч, в частности при концентрациях свыше 190 мкг/мл отмечен токсический эффект на эпителиальную клеточную линию человека, а при внутрибрюшинном введении SiO2-нч в дозе 50 мкг/кг мышам отмечается активация перитонеальных макрофагов [7].
С учетом вышеизложенного, целью исследования стало изучение влияния прекондиционирования с SiO2-нч на морфофункциональные свойства костномозговых ММСК крыс Wistar.
Материалы и методы исследования
Коллоидный диоксид кремния (энтеросорбент «Полисорб», Россия) подвергали механической обработке в шаровой мельнице (энергонапряженность 1g) для получения большего количества мелкодисперсных (менее 5 мкм) SiO2-нч. Эксперименты на 5 крысах-самках линии Wistar с массой 300-350 г. проведены в соответствии с соблюдением принципов Хельсинской декларации BMA (2000). Ядросодержащие клетки костного мозга получали при помощи перфузии бедренных костей лабораторных животных и использовали для выделения ММСК. Для этого ядросодержащие клетки костного мозга ресуспендировали в среде DMEM (Биолот, СПб) и пропускали через фильтр (размер пор 80 мкм) для удаления клеточного дебриса, подсчитывали количество жизнеспособных клеток. Далее ядросодержащие клетки костного мозга инкубировали в пластиковых флаконах (TPP, Швейцария) в среде DMEM (Биолот, СПб), дополненной 100 мкг/мл гентамицина сульфата (Дальхимфарм, Хабаровск), 2 мM L-глютамина (ICN, США) и 15 % FCS при 37°С в атмосфере 5 % СО2. Через 48 часов неприкрепленные к пластику клетки удаляли, а прилипающую фракцию клеток культивировали до получения конфлюэнтного слоя. Снятие ММСК при пассировании осуществляли с использованием 0,25 % раствора трипсина/0,02 % раствора ЭДТА (ICN, США). Адгезию ММСК к пластику при кондиционировании с различными дозами SiO2-нч (2, 20 и 200 мкг/мл) оценивали под инвертированным микроскопом Olympus (Япония). На проточном цитофлуориметре FACS Canto II (BD, США) изучали влияние кондиционирования ММСК с SiO2-нч на клеточный цикл. Пролиферативный потенциал ММСК изучали по включению по включению 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромида – МТТ (Sigma, США) при длине волны 492 нм на спектрофотометре (Stat Fax 2100, США) через 48 часов при со-культивировании с различными дозами SiO2-нч и выражали в условных единицах оптической плотности. Индекс влияния SiO2-нч высчитывали по формуле: ИВ= (1 – опыт/контроль) х 100 %. Уровень продукции стойких метаболитов оксида азота (mNO) ММСК при кондиционировании с различными дозами SiO2-нч оценивали с помощью реактива Грейсса. Статистическую обработку данных проводили с использованием программы Statistica 6.0, меры центральной тенденции и рассеяния описаны медианой (Ме), нижним (Lq) и верхним (Hq) квартилями; достоверность различия рассчитывалась по U-критерию Манна-Уитни, и принималась при значениях p < 0,05 [1].
Результаты исследования и их обсуждение
Ранее было показано, что коллоидный аморфный диоксид кремния состоял из округлых наночастиц размером 20-100 ни, сорбированных в рыхлые агрегаты размером 5-100 мкм [2]. В водной среде агрегаты частично разрушались. Количество частиц коллоидного диоксида кремния менее 3 мкм не превышало 0,5 %, менее 5 мкм – 5,3 % и менее 10 мкм – 25,7 % при исследовании гранулометрического состава микрокомпозиционного исходного материала диоксида кремния. После механического измельчения массовая доля мелких (менее 3-5 мкм), потенциально наиболее биологически активных частиц увеличивается при механохимической активации от 23 % до 38 %.
Как видно из рис. 1, отмечено влияние SiO2-нч на адгезию ММСК к пластику. Так при концентрациях 20 мкг/мл и 200 мкг/мл SiO2-нч при микроскопии уже через 3 часа после посадки клеток в лунки отмечено появление областей, которые не заселяется ММСК (рис. 1 д, ж). А через 48 часов это наиболее ярко проявляется при концентрации 200 мкг/мл SiO2-нч (рис. 1 з).
Следовательно, SiO2-нч в высоких концентрациях препятствуют прикреплению ММСК к пластику.
Показано, что SiO2-нч статистически значимо снижает интенсивность пролиферации ММСК, что подтверждается не только абсолютными величинами поглощения клетками МТТ, но и интегральным показателем влияния SiO2-нч на ММСК (табл. 1). Показано, что максимальный ингибирующий эффект SiO2-нч проявляется при дозе 200 мкг/мл.
В то же время, нами не отмечено статистически значимого влияния SiO2-нч на секреторный потенциал ММСК, определяемый по уровню продукции стойких метаболитов оксида азота.
Показано наличие прямой и сильной взаимосвязи между спонтанным уровнем пролиферации ММСК и уровнем продукции стойких метаболитов оксида азота при кондиционировании с 20 мкг/мл SiO2-нч. Это подтверждается и данными визуализации реакции МТТ – теста (рис. 2). Видно, что количество ММСК гранул МТТ преобразованных в формазан меньше по мере возрастания дозы SiO2-нч.
Таким образом, SiO2-нч в высоких дозах подавляют пролиферативный потенциал ММСК.
Следующим этапом исследования стал анализ нахождения ММСК в фазах клеточного цикла при кондиционировании их с различными дозами SiO2-нч. Показано, что SiO2-нч статистически значимо увеличивает количество апоптотических клеток (табл. 2). Также SiO2-нч статистически значимо уменьшают количество ММСК в G0G1, G2+M и S-фазах клеточного цикла.
Таким образом, высокие дозы SiO2-нч стимулируют апоптоз ММСК.
Полученные нами результаты влияния SiO2-нч на ММСК не противоречат литературным данным. Так в работе авторов [4] показано, что SiO2-нч проявляют токсическое действие на ММСК крысы при концентрациях свыше 80 мкг/мл. В основе токсического эффекта SiO2-нч на ММСК человека лежит активация генов оксидативного стресса [8]. Более того, SiO2-нч наряду с наночастицами оксида титана проявляют токсический эффект и на стволовые нервные клетки человека при концентрации 100 мкг/мл, что связано с нарушением экспрессии маркеров стволовых клеток нервной системы и маркеров нейронов [5].
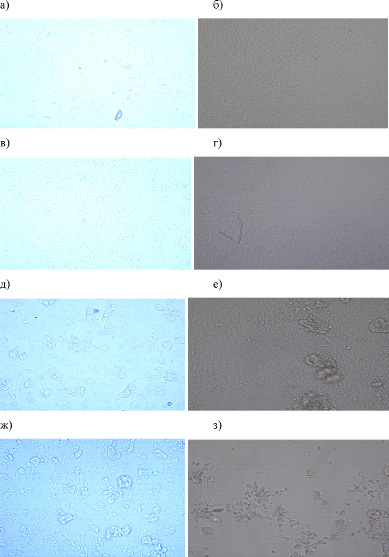
Рис. 1. Эффект прекондиционирования ММСК с SiO2-нч на адгезию к пластику: а – ММСК через 3 часа, б – ММСК через 48 часов, в – ММСК+2 мкг/мл SiO2-нч через 3 часа, г – ММСК+2 мкг/мл SiO2-нч через 48 часов, д – ММСК+20 мкг/мл SiO2-нч через 3 часа, е – ММСК+20 мкг/мл SiO2-нч через 48часов, ж – ММСК+200 мкг/мл SiO2-нч через 3 часа, з – ММСК+200мкг/мл SiO2-нч через 48 часов. Нативный препарат (х400)
Таблица 1
Эффект прекондиционирования ММСК с SiO2-нч (Me; LQ-UQ)
|
Параметры |
Уровень пролиферации (в ед опт. пл.) |
Индекс влияния (в %) |
Уровни продукции mNO (в μM/mL) |
|
ММСК |
1,65 1,64 – 1,68 |
100 |
10,64 5,79 – 14,68 |
|
ММСК + 2 мкг/мл SiO2-нч |
1,45* 1,43 – 1,46 |
- 11,60* 11,28 – 13,31 |
13,12 8,81 – 20,15 |
|
ММСК + 20 мкг/мл SiO2 |
1,35*, # 1,34 – 1,36 |
- 18,62*,# 17,58 – 19,17 |
14,59 12,47 – 22,60 |
|
ММСК + 200 мкг/мл SiO2 |
1,10*, #,$ 1,09 – 1,12 |
- 33,61*,#,$ 31,90 – 33,94 |
11,00 8,62 – 30,52 |
Примечание. ММСК – мультипотентные мезенхимальные стволовые клетки; SiO2-нч – наноструктурированные частицы диоксида кремния; * – достоверность различия с ММСК p < 0,05; # – достоверность различия с ММСК+2 мкг/мл SiO2-нч p < 0,05; $ – достоверность различия с ММСК+20 мкг/мл SiO2-нч p < 0,05.
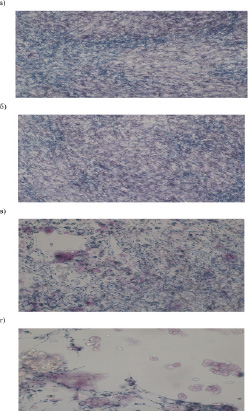
Рис. 2. Эффект прекондиционирования ММСК с SiO2-нч на поглощение МТТ: а – ММСК, б – ММСК+2 мкг/мл SiO2-нч, в – ММСК+20 мкг/мл SiO2-нч, г – ММСК+200 мкг/мл SiO2-нч. Нативный препарат (х400)
Таблица 2
Эффект прекондиционирования ММСК с SiO2-нч на клеточный цикл (Me; LQ-UQ)
|
Параметры |
Фазы клеточного цикла (в %) |
|||
|
< 2N |
2N |
> 2N |
4N |
|
|
ММСК |
5,00 5,00 – 6,00 |
75,20 73,00 – 75,20 |
12,70 10,70 – 12,70 |
7,10 7,10 – 10,10 |
|
ММСК + 2 мкг/мл SiO2-нч |
10,70* 10,70 – 11,50 |
75,20 75,20 – 76,00 |
12,70 10,50 – 12,70 |
7,10 6,80 – 7,10 |
|
ММСК + 20 мкг/мл SiO2 |
10,70* 9,50 – 10,70 |
66,90*,# 66,90 – 70,50 |
12,60 12,20 – 12,60 |
7,60# 7,60 – 7,80 |
|
ММСК + 200 мкг/мл SiO2 |
44,90*,#,$ 44,90 – 45,60 |
41,90*,#,$ 40,00 – 41,90 |
8,20*,#,$ 8,20 – 9,00 |
5,00*,#,$ 5,00 – 6,40 |
Примечание. ММСК – мультипотентные мезенхимальные стволовые клетки; SiO2-нч – наноструктурированные частицы диоксида кремния; * – достоверность различия с ММСК p < 0,05; # – достоверность различия с ММСК+2 мкг/мл SiO2-нч p < 0,05; $ – достоверность различия с ММСК+20 мкг/мл SiO2-нч p < 0,05.
Заключение
Таким образом, наночастицы диоксида кремния проявляют токсическое влияние на мультипотентные мезенхимальные стволовые клетки в дозе 200 мкг/мл. Необходимо учитывать побочные эффекты наноструктурированных частиц диоксида кремния при применении их в медицине, фармации и при разработке диагностических средств, направленных на определение живых клеток с помощью внедрения светящихся меток, так как высока вероятность гибели клеток от наночастиц до момента их детекции на специальной аппаратуре.

