Известно, что различные воздействия на воду приводят к изменению физико-химических характеристик водных систем, таких, как рН, окислительно-восстановительный потенциал, электропроводность, диэлектрическая проницаемость, показатель преломления, спектры поглощения и излучения и др. [1,2]. При действии даже таких факторов, как нагрев и солнечный свет в воде изменяется концентрация активных форм кислорода [3]. Бесконтактная электрохимическая химическая активация растворов приводит к значительным изменениям их свойств, которые выражаются либо в изменении ОВП растворов, которое носит обратимый характер, либо приводит к необратимым химическим превращениям без изменения ОВП [4]. При этом между физико-химическими свойствами воды и ее биологической активностью связь неоднозначная. Более того, при отсутствии заметных изменений свойств воды, ее биологическая активность может варьировать в широких пределах. Морфологические клеточные исследования печени после годичного потребления бесконтактно активированных вод выявили ее повреждающее действие [5]. В качестве первичных мишеней действия различных физических факторов могут быть белки.
Целью данной работы было исследование влияния бесконтактной электрохимической активации (БЭХА) на растворы белков. В качестве объектов исследования были использованы растворы бычьего сывороточного альбумина (БСА), пероксидазы из корней хрена (ПХ), аспартатаминотрансферазы (АСТ).
Материалы и методы исследования
Активатор электрический модель «Здрава – 3.3» (изготовитель ОАО «Дальприбор», разработчик ЗАО НИЦ «Икар», Ижевск). Активатор «Здрава» представляет собой емкость в виде полого цилиндра вместимостью 3000 мл. В этом активаторе реализован бездиафрагменный способ активации. Катодом служит внутренняя поверхность корпуса активатора, анод выполнен в виде стержня и расположен вертикально в центре емкости для активации. Особенностью данного активатора является постоянство значений рН при активации. Бесконтактную активацию проводили в пищевых одноразовых стаканах из полипропилена, вместимостью 100 мл с толщиной стенки не более 0,3 мм. Стакан помещали в специальный держатель, держатель вместе со стаканом погружали в водопроводную воду, очищенную бытовым фильтром «Гейзер». Объем воды в активаторе составлял 3000 мл, объем раствора в стакане – 50–100 мл.
ОВП растворов измеряли с помощью иономера «Экотест-120» (НПП «Эконикс», Москва). Измерительным электродом служил высокотемпературный платиновый электрод ЭПВ-1ср., (РУП «Гомельский завод измерительных приборов», Беларусь); в качестве электрода сравнения использовали хлорсеребряный электрод ЭВЛ-1М3.1 (РУП «Гомельский завод измерительных приборов», Беларусь).
Спектры поглощения и флуоресценции, а также светорассеяние растворов измеряли на спектрофлуориметре СМ2203 (ЗАО «Солар», Беларусь).
Реактивы: коммерческий препарат пероксидазы хрена (BBI Enzymes, ООО «ДИАЭМ»), эмбриональная телячья сыворотка (PAA), о-фенилендиамин (ч.д.а.), перекись водорода, 37 % (мед.), NaH2PO4∙2H2O (Panreac, PRS), Na2HPO4∙12H2O (Panreac, PRS), KNO3 (ч.д.а., Реахим) использовали без предварительной очистки. В качестве растворителя использовали бидистиллированную воду.
Растворы ПХ готовили растворением фермента в 0,01 М натрий-фосфатном буфере (рН=7), содержащем 0,1 М нитрат калия. Раствор о-фенилендиамина (ФДА) готовили путем растворения соответствующей навески в 96 % этаноле, рабочий раствор перекиси водорода получали путем разбавления исходного раствора бидистиллятом. Концентрацию ПХ и перекиси водорода контролировали спектрофотометрически. Использовали диапазон концентраций пероксидазы хрена, где начальная скорость окисления субстрата прямо пропорциональна концентрации фермента.
Влияние БЭХА на растворы БСА оценивали непосредственно по изменениям спектров флуоресценции при длине возбуждающего света 280 и 300 нм, – на растворы ПХ по скорости пероксидазного окисления ФДА. Скорость реакции определяли по формуле V=(Di – Do)/ t, активность ПХ приравнивали к V и выражали в условных единицах. Измерения оптической плотности проводили при длине волны, равной 430 нм в одноразовых кюветах из полистирола с геометрическими размерами 10х10х45 мм. Соотношения реагентов выбирали в соответствии с [6]. К 2,1 мл 0,01 М Na-фосфатного буфера, содержащего 0,1 М КNO3 (рН 7), добавляли 0,2 мл 5 нМ раствора пероксидазы и 0,1 мл 0,43 мМ о-фенилендиамина в 96 % этаноле и помещали в кюветное отделение спектрофлуориметра с заданной температурой 22±0,5°С, добавляли 0,1 мл 16 мМ раствор перекиси водорода, перемешивали раствор и начинали регистрацию оптической плотности в автоматическом режиме с интервалом 1 минута. Время измерений составляло 5-10 минут. Измерения скорости реакции пероксидазного окисления ФДА проводили при разных значениях ОВП натрий-фосфатного буфера, варьируя время его активации.
Изменение активности АСТ проводили, используя тест-наборы «Аспартатаминотрансфераза ФС» (ЗАО «Диакон ДС») в соответствие с прилагаемой инструкцией. Для повышения точности определений время регистрации оптической плотности было увеличено до 10 минут. Активность АСТ рассчитывали по формуле: А=1745х(D0-D10), где D0 и D10 -оптическая плотность раствора в нулевой момент времени и спустя 10 минут соответственно, 1745 – фактор пересчета для выражения активности АСТ в Е/л.
Результаты исследования и их обсуждение
Известно, что процессы электрохимической активации воды сопровождается изменениями физико-химических свойств растворов. В частности, окислительно-восстановительный потенциал католита испытывает сильный сдвиг в сторону отрицательных значений [1]. Существует мнение, что низкие значением ОВП католита обусловлены его восстановительными свойствами [1]. Однако установлено, что католит дистиллированной воды не восстанавливает феррицианид калия и 5,5’-дитиобис-(2-нитробензойную кислоту) [7], растворы сильных окислителей при активации могут иметь отрицательные значения ОВП без утраты ими окислительных свойств [4], а отрицательные значения ОВП на платиновом электроде не отражают восстановительные свойства активированных растворов [8].
При контактной электрохимической активации (электроды погружены в раствор) наряду с активацией происходят и химические превращения в системе. Для того чтобы минимизировать химические реакции в исследуемой системе, использовали бесконтактную активацию. При бесконтактной активации в качестве «активатора» используют электрохимически активированную жидкость. В настоящее время бесконтактно активированные растворы исследованы мало, природа БЭХА не ясна, а процесс БЭХА является слабо управляемым.
Влияние БЭХА на спектрально-люминесцентные свойства БСА. Для исследования влияния БЭХА на спектрально-люминесцентные свойства БСА исследуемый раствор заданной концентрации помещали в активатор и выдерживали в нем заданное время. Кратковременную активацию проводили в работающем активаторе в течение 1 – 3 часов. Длительную активацию проводили при работающем активаторе в течение 1-3 часов, затем, активатор отключали и выдерживали раствор БСА в активированной жидкости в течение 15-70 часов. По окончании времени активации измеряли спектры флуоресценции контрольного и активированного образцов при длине волны возбуждения 280 нм и 300 нм (рис.1), а также светорассеяние растворов. Выбор длины волны возбуждения был обусловлен следующими обстоятельствами. Максимум в спектре поглощения БСА лежит при вблизи 280 нм. При возбуждении λ=280 нм вклад в наблюдаемую флуоресценцию раствора вносят тирозиновые и триптофановые фрагменты молекулы белка, в то время как флуоресценция, возбуждаемая светом 300 нм, обусловлена остатками триптофана.
При активации раствора БСА с концентрацией 1,6х10-4 г/мл в течение 1- 3 часов удалось достичь значений ОВП -40 мВ. Изменения в спектрах флуоресценции при длинах волны возбуждения 280 и 300 нм, как правило, не наблюдали. Однако в некоторых случаях наблюдались обратимые изменения интенсивности флуоресценции активированных растворов, обусловленные обратимыми изменениями конформации молекулы БСА. При длительной активации происходят необратимые изменения в спектрах флуоресценции и рассеяния растворов, причем эффект БЭХА более выражен в растворах меньшей концентрации.
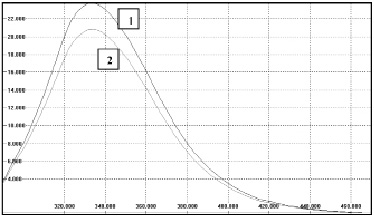
Рис. 1. Спектры флуоресценции исходного (1) и активированного (2) растворов БСА. Длина волны возбуждения 280 нм. С=1,275х10-4 г/мл
Таблица 1
Флуоресценция и рассеяние активированных растворов БСА
|
Образец |
С, г,мл |
Условия активации |
ОВП, мВ |
I336/300 |
I336/280 |
I700/700 |
|
Исходный |
8,5х10-4 |
- |
335 |
21,890±0,076 |
79,831±0,107 |
3,687±0,341 |
|
БЭХА |
8,5х10-4 |
1час 30 минут + 18 часов |
117 |
22,413±0,040 |
80,872±0,192 |
4,598±0,270 |
|
Исходный |
1,275х10-4 |
- |
328 |
3,578±0,004 |
23,966±0,074 |
1,857±0,092 |
|
БЭХА |
1,275х10-4 |
2 часа 30 минут + 68 часов |
181 |
3,318±0,007 |
21,735±0,076 |
4,835±0,126 |
|
Исходный |
1,615х10-4 |
- |
348 |
4,390±0,003 |
27,137±0,069 |
5,320±0,120 |
|
БЭХА |
1,615х10-4 |
2 часа |
-40 |
4,444±0,004 |
27,249±0,066 |
6,207±0,063 |
Фильтрование растворов БСА, подвергнутых БЭХА через шприцевые фильтры из PVDF с размером пор 0,45 µm приводит к уменьшению светорассеяния до величин, характерных для свежеприготовленных растворов. Полученные экспериментальные данные позволяют предположить, что увеличение светорассеяния активированных растворов связано с укрупнением частиц, обусловленное агрегацией белковых молекул.
Влияние БЭХА на активность АСТ. Имеется патент США [9], в котором на малых группах исследуемых показано, что наилучшим показателям здоровья соответствуют более низкие значения ОВП его биологических жидкостей. Однако в целом нет однозначных данных и рекомендаций относительно оптимальных значений ОВП внутренней среды организма. Имеющиеся в литературе сведения малочисленны и противоречивы. Лечебная эффективность направленного уменьшения ОВП внутренней среды организма доказана лишь для обеспечения радиопротекторного эффекта при лучевой нагрузке [10].
Задачей исследования было определение активности АСТ при разных значениях ОВП исследуемой сыворотки. АСТ катализирует обратимый перенос аминогруппы с L-аспартата на α-кетоглатурат с образованием оксалоацетата и L-глутамата. Затем оксалоацетат в присутствие малатдегидрогеназы восстанавливается до малата с окислением восстановленного NADH в NAD. Скорость окисления NADH прямо пропорциональна активности АСТ. Эмбриональную телячью сыворотку бесконтактно активировали в течение 1,5 часа. При этом исходные значения ОВП=249 мВ; рН=7,31 изменялись до ОВП= -247; рН=7,40. Далее проводили параллельные определения активности АСТ в исходной и активированной сыворотке. Зависимость оптической плотности от времени в обоих случаях в исследуемый промежуток времени является прямолинейной. Качественных изменений при активации сыворотки не происходило, а наблюдалось лишь некоторое ускорение реакции, связанное с увеличением активности АСТ.
Влияние БЭХА на скорость пероксидазного окисления ФДА. Оценку влияния БЭХА на реакцию пероксидазного окисления о-ФДА проводили двумя способами: 1) путем активации раствора ПХ; 2) путем проведения реакции в активированном буфере. Реакция окисления о-ФДА широко используется в ферментативном анализе. Считают, что конечным продуктом окисления о-ФДА является 2,3-диаминофеназин, окрашенный в желто-оранжевый цвет, максимум поглощения которого лежит при 420-450 нм [11]. Регистрацию изменений оптической плотности растворов в ходе пероксидазного окисления окисления о-ФДА проводили при длине волны 430 нм. Зависимость оптической плотности растворов при λ=430 нм от времени, представляет собой прямую, тангенс угла наклона которой равен скорости реакции окисления о-ФДА (рис. 2). В первом случае, когда активировали непосредственно раствор ПХ, наблюдали небольшое ускорение реакции, как и в случае АСТ, обусловленное увеличением активности фермента (рис. 2, табл. 2).
Во втором случае, скорость реакции практически не зависела от значения окислительно-восстановительного потенциала буферного раствора в области положительных и отрицательных значений ОВП вплоть до – 190 мВ. Затем наблюдалось резкое падение скорости реакции, которое оставалось неизменным при дальнейшем понижении ОВП. В таблице 3 представлены значения скорости реакции пероксидазного окисления ФДА при некоторых значениях ОВП.
Таблица 2
Изменение активности АСТ и ПХ при бесконтактной электрохимической активации.
|
Образец |
Состояние |
Время активации |
Активность |
|
АСТ |
исходный |
- |
16,55±0,50 Е\л |
|
АСТ |
активированный |
1,5 |
17,85±0,57 Е/л |
|
ПХ |
исходный |
- |
3,88±0,16 усл. ед. |
|
ПХ |
активированный |
2 |
4,59±0,18 усл.ед |
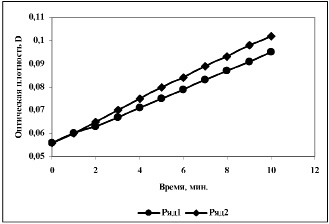
Рис. 2. Зависимость оптической плотности растворов о-ФДА при пероксидазном окислении с участием необработанной (1) и бесконтактно активированной (2) пероксидазы хрена
Таблица 3
Зависимость скорости пероксидазного окисления о-ФДА от ОВП буферного раствора
|
ОВП, мВ |
330 |
285 |
117 |
86 |
0 |
-85 |
-170 |
-198 |
-272 |
|
Vx1000, D/мин. |
9,02± 0,08 |
8,95± 0,10 |
8,3± 0,19 |
9,01± 0,17 |
9,0± 0,15 |
8,3± 0,21 |
8,8± 0,16 |
2,68± 0,14 |
2,68± 0,11 |
Выводы:
1. БЭХА в той или иной степени оказывает влияние на БСА, ПХ и АСТ.
2. Бесконтактная электрохимическая активация в течение 1-3 часов не приводит к заметным изменениям спектрально-люминесцентных свойств растворов БСА, агрегации или гидролизу белковых молекул. При длительной активации наблюдается уменьшение интенсивности свечения и увеличение светорассеяния растворов, обусловленное агрегацией молекул БСА.
3. При БЭХА ферментов ПХ и АСТ наблюдается увеличение их активности в пределах 4–8 %.
4. Скорость пероксидазного окисления ФДА не зависит от ОВП реакционной среды (натрий-фосфатного буфера) вплоть до значений – 190 мВ. При понижении ОВП до – 200 и ниже наблюдается резкое ингибирование реакции.

