В настоящее время среди методов клеточной биологии широко используются так называемые переживающие срезы нативной ткани («slаces», толщина слайсов – 200–400 мкм). Особенно много работ на слайсах проводится в различных исследованиях центральной нервной системы [1,9 и др.]. Однако метод переживающих срезов можно использовать в различных областях экспериментальной клеточной биологии: сочетание с электронной микроскопией, длительным культивированием эксплантатов ткани, в интравитальной микроскопии in vitro и др.
Невзирая на то, что ряд фирм выпускает коммерческие приборы для получения слайсов (резаки, вибратомы), продолжаются поиски новых технических решений приборов для микротомирования нативной ткани.
В данной статье рассматривается конструкция оригинального резака нативной ткани, на основе модификации стандартного ротационного микротома.
Описание конструкции микротома-резака
1. Базовая конструкция модифицированного ротационного микротома
В основе устройств использована стандартная схема ротационного микротома для получения гистологических срезов из фиксированной ткани (рис. 1).
Микротомный узел закреплен на общем основании (1). на вертикальной станине (2) каретка (3), совершает вертикальное поступательно-возвратное движение при помощи кривошипо-шатунного механизма (на схеме не показан). на каретке закреплена пластинка (4) с направляющими типа «ласточкин хвост». Вдоль пластинки (4) двигается призма (5). В стандартном ротационном микротоме на переднем конце призмы закреплен блок ткани, который двигается на определенное расстояние вперед и при движении каретки (3) вниз ткань режется ножом микротома, закрепленном на основании микротома (1). на другом конце призмы имеется гайка (7), в которой двигается специальный правозаходный микровинт (8). на заднем конце оси микровинта имеется шаровая опора (9) и храповое колесо (10). При движении храпового колеса по часовой стрелке, при каждом цикле вертикального движения каретки (3) микровинт продвигает вперед призму (5) на расстояние определяемое шагом микровинта и величиной поворота храпового колеса. Обычно толщина срезов, получаемых на ротационном микротоме, находится в диапазоне (0,5)1 – (15)20 мкм.
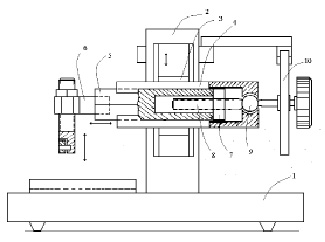
Рис. 1. Схема базовой конструкции резака. Объяснения в тексте
2. Модификация ротационного микротома для резки нативной ткани
а) Вместо ручного привода движения каретки (3) разработан специальный электропривод (на рис. 1 не показан), обеспечивающий работу кривошипо-шатунного механизма, приводящего в движение каретку (3). Дистанционное управление электроприводом (ножная педаль) освобождает руки экспериментатора для манипуляции со срезами нативной ткани.
б) Устанавливается микровинт (8) с левосторонней пятизаходной резьбой с шагом 5 мм. Храповое колесо с 200-ю зубцами позволяет осуществлять передвижение призмы назад от оператора на расстояние 25 мкм/на зуб колеса.
в) На основании микротома укрепляется кювета, в которой в специальный держатель в виде ванночки из желатины (агара) (рис. 2а) помещается нативная ткань.
Дно кюветы (1) имеет паз (2) глубиной 1 мм и шириной 15 мм. по бокам паза закреплены две пластинки (3) из нержавеющей стали толщиной 0.2 мм. Внутрь паза помещается желатиновый держатель ткани в виде ванночки (4). Держатель ткани помещается у передней стенки кюветы, а затем плавным движением вдвигается в паз. Желатиновая ванночка-держатель ткани прочно удерживается в пазе кюветы пластинками (3). В центральный канал желатиновой ванночки помещается образец ткани (5). Кювета (1) закрепляется на основании микротома-резака (6).
г) В переднюю часть призмы (5) вставляется держатель режущего инструмента (6 на рис. 1; рис. 2а, в). Держатель представляет рамку, в которой натянута половинка лезвия безопасной бритвы (режущий инструмент). Вид сверху (рис. 2в) показывает, что рамка держателя имеет хвостовик (14) для вставки в призму и винт (13), при помощи которой фиксируется угол положения рамки относительно образца нативной ткани.На рис. 2а показано крайнее нижнее положение режущего инструмента. Видно, что режущая кромка лезвия бритвы (7) не касается поверхности кюветы. В начале работы призма с держателем режущего инструмента перемещается в крайнее переднее положение ручкой храпового колеса. При резке режущий инструмент уходит назад от оператора, а срез ткани остается на передней стенке лезвия бритвы.
Для приготовления желатиновых ванночек используется специальное приспособление (рис.2б), состоящее из двух деталей: основания (8) и крышки (9). Крышка имеет выступы (10), размеры которых определяют ширину агаровых ванночек. Основание устройства имеет перегородки (11), определяющие размер канала в желатиновой ванночке (12). В пространство между основанием и крышкой заливается нагретый 6-8 % раствор желатины. После охлаждения желатины устройство разбирается, ванночки вынимаются и хранятся до использования в холодильнике в закрытой влажной камере (чашка Петри). В зависимости от размера образца ткани, определяется размер перегородок в основании описанного устройства. Например, для приготовления переживающих срезов хвостатого ядра мозга крысы (nuc. caudatus), мы использовали желатиновый ванночки с размером канала 4 х 4 мм.
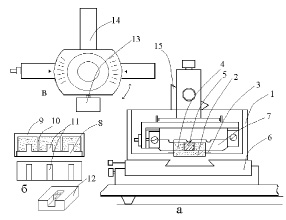
Рис. 2. Схема кюветы, блока режущего инструмента и устройства для приготовления агаровых ванночек. Объяснение в тексте
Обсуждение. Для приготовления срезов нативной ткани в разное время было предложен ряд устройств для ручного и механизированного приготовления слайсов [2, 3, 6-8 и др.].
В описанной конструкции резака на основе модификации стандартного ротационного микротома удачно решено надежное закрепление образца нативной ткани относительно режущего инструмента. Применение агаровых ванночек, предложенное в данной работе, имеет явные преимущества перед описанными в литературе способами (закрепление образцов ткани на фильтровальной бумаге при помощи агара, желатины или полимерных (акриловых) клеев).
Описанный резак позволяет надежно готовить из нативной ткани слайсы толщиной 200-400 мкм. Известно, что именно этот диапазон толщин позволяет проводить изучение электрической активности нейронов в слайсах (in vitro).
Использование электропривода с дистанционным управлением позволяет быстро готовить небольшие серии слайсов из различных тканей.
Особенно удачно описанный резак был использован при получении слайсов из разных отделов головного мозга лабораторных животных для проведения электрофизиологических исследований (см., например, [4, 5, 10 и др.].
Работа поддержана грантом РФФИ, проект 14-00-295.

