Пирометаллургическое производство цветных металлов характеризуется образованием большого количества отходов производства, основными из которых являются шлаки. Так на медеплавильных заводах при производстве тонны меди выделяется 2–4 т шлаков плавильного, конвертерного и рафинировочного переделов. Комплексное использование техногенных отходов, к которым относятся шлаки, создает предпосылки для экономии природных ресурсов и укрепления минерально-сырьевой базы цветных металлов.
Согласно данным [1] большие объемы медьсодержащих продуктов сосредоточены именно в шлаках: 31 млн тонн отходов Балхашского горнометаллургического комбината (БГМК) содержат 250 тыс. т меди. Практическое отсутствие у БГМК собственных сырьевых источников (Коныратский и Саякский рудники на стадии выработки, Шатыркульский рудник осваивается) почти наполовину компенсируется добычей меди флотационным обезмеживанием отвальных шлаков [2]. Однако, несмотря на вовлечение шлаков в технологический цикл, проблема их утилизации остается нерешенной, и требует разработки дополнительных технологических мероприятий.
Одним из перспективных направлений переработки шлаков представляется их восстановительная обработка с переводом железа в металлическое состояние, которое может рассматриваться в качестве матрицы, цементирующей медь из кислотных растворов, например отработанного медного электролита этого же предприятия. Процесс цементации основан на различии в величинах нормальных потенциалов меди и металла-осадителя. Наиболее распространенным осадителем для меди является железная стружка, железный порошок или железный скрап достаточно дефицитные и дорогие материалы [3].
Попутное извлечение меди и др. компонентов, присутствующих в шлаке, также позволит повысить комплексность использования сырьевых источников и сделать переработку экономически оправданной.
Таким образом, перед нами встала задача металлизации отвального медного шлака. В качестве объекта исследования использован отвальный шлак БГМК состава, %: 34,8 Feобщ; 38,8 SiO2, 6,8 CaO, 0,57 Cu, 1,64 S, 1,1 Pb, 0,8 Zn, 0,4 As.
Так как шлак медеплавильного производства в основном представлен фаялитом Fe2SiO4 (рис. 1), то была поставлена задача изучения протекания реакций:
Fe2SiO4 + C + 2CaO = Ca2SiO4 + 2Fe + CO2 (1)
Fe2SiO4 + C =FeO∙SiO2 + CO + Fe (2)
Для изучения реакций твердофазного восстановления были взяты следующие шихтовые материалы: Fe2SiO4 (синтезированный реагентов ч.д.а.при 1250 °С в печи Таммана), в качестве флюса известняк Южно-Топарского месторождения (СаО = 54,07 %) и в качестве углеродсодержащего восстановителя – коксовая мелочь АО «ArсelorMittal Темиртау» (С = 85 %). Расчет расхода углеродсодержащего восстановителя определялся с учетом стехиометрических коэффициентов уравнений реакций 1 и 2.

Рис. 1. РФА отвального шлака Балхашского медеплавильного завода.  – Fe2SiO4 (фаялит),
– Fe2SiO4 (фаялит),  – FeSiO3 (ферросилит),
– FeSiO3 (ферросилит),  – Fe(Са)SiO3(клиноферрит)
– Fe(Са)SiO3(клиноферрит)
а) б)
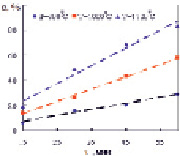
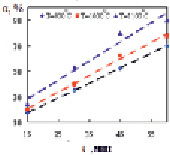
Рис. 2. Изменение степени восстановления от продолжительности восстановления Fe2SiO4 (а) и Fe2SiO4 в смеси с СаО (б)
Восстановление проводили в трубчатой электропечи СУОЛ-044 12-М2 [2] при температурах 900, 1000, 1100 °С с выдержкой при каждой температуре 15, 30, 45, 60 минут. Результаты представлены в виде графиков (рис. 2).
Как следует из графиков повышение температуры и продолжительности обжига ведут к линейному росту степени восстановления. Степень восстановления определена как отношение количества кислорода переведенного в газовую фазу к его количеству в исходных соединениях. Наибольшая степень восстановления Fe2SiO4 достигнута при температуре 1100 °С и выдержке более 60 минут. Добавка в шихту оксида кальция интенсифицирует восстановление. Так при температуре 1000 °С и выдержке 60 мин значение α составляет ~ 57 %, а в тех же условиях с добавкой СаО – 71 %; аналогично при 1100 °С и 60 мин – 80 % и 91 %, соответственно.
Обобщенные уравнения зависимости степени восстановления железа (α) от температуры (Т, °С) и продолжительности (τ, мин) углеродом (3) и с добавлением СаО (4) имеют вид:
α = – 136 + 0,19Т – 690/τ, r2 = 0,81 (3)
α = – 26,25 + 0,11Т – 1001/τ, r2 = 0,86 (4)
Магнитная сепарация восстановленных продуктов дала следующие результаты: масса магнитной фракции при сепарации огарка восстановленного при температуре 1000 °С в течение 60 минут составляет ~ 36 %. В тех же условиях, но с добавлением СаО – 49 %, а повышение температуры до 1100 °С (60 мин) сопровождается ростом магнитной фракции до 49 и 55 % соответственно. Селективного извлечения железа в магнитную фракцию не достигнуто, что связано с тонкой вкрапленностью металла. Обобщенные уравнения зависимости выхода магнитной фракции (γ) от параметров восстановления (Т, °С, τ, мин) углеродом (5) и с добавлением СаО (6) имеют вид:
γ = – 69,1 + 0,10Т – 397/τ, r2 = 0,79 (5)
γ = – 53,34 + 0,05Т – 612/τ, r2 = 0,90 (6)
Эксперименты по восстановлению отвального шлака Балхашского медеплавильного завода (Feобщ – 34,8 %, фазовый состав представлен на рис. 3) углеродом кокса проведены в неизотермических условиях при нагреве (10 °С/мин) до 900 °С, 1000 и 1100 °С с последующей выдержкой при заданной температуре в течение 30, 45 и 60 минут. Количество выделяющегося газа фиксировали газовым счетчиком. В первые 30–35 минут опыта (540–800 °С), когда объем выделяющегося газа незначителен, происходит лишь частичное восстановление компонентов шлака, оксидов меди и свинца. Выше 800 °С зафиксировано резкое увеличение объема выделяющегося газа, свидетельствующее о восстановлении железа.
Обобщенное уравнение металлизации шлака имеет вид:
α = – 53,76 + 0,15Т – 1191/τ, r2 = 0,86 (7)
Максимальное значение степени металлизации – 89,9 % достигнуто при 1100 °С и продолжительности обжига 60 мин (рис. 3). Однако при указанной температуре наблюдали частичное спекание шихты, затрудняющее завершение твердофазного восстановления шлака. Поэтому рекомендован восстановительный обжиг при 1050 °С и продолжительности 60 мин, обеспечивающий степень металлизации шлака 85 %.
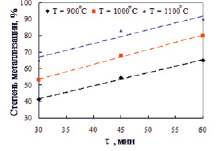
Рис. 3. Изменение степени металлизации железа от продолжительности восстановительного обжига шлака с коксовой мелочью
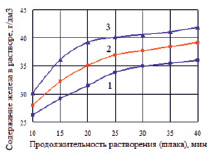
Рис. 4. Изменение содержания железа в водном растворе H2SO4 от продолжительности его перемешивания (Vперем = 100 об/мин) со шлаком имеющим степень металлизации 51 % (1), 68 % (2) и 89 % (3)
Полученный металлизованный продукт, предполагается использовать в качестве нейтрализатора кислых растворов, в частности отработанного медного электролита. С этой целью были изучены условия растворения восстановленного железа шлака в сернокислом растворе (2Н). Как следует из графиков (рис. 4) в первые 20 минут имеет место интенсивный переход железа в раствор для всех трех образцов, затем процесс замедляется в связи с насыщением раствора железом и недостатком кислоты. Повышение степени металлизации шлака способствует насыщению раствора по железу (Fe2+).
При соотношении масс раствор/шлак равном 5, получены растворы, содержащие 36–43 г/дм3 железа (178–213 г/дм3 FeSO4∙7Н2О). Такие растворы могут быть использованы при автоклавном выщелачивании свинцовоцинковых концентратов или для обезвреживания сточных вод ТЭЦ.
Таким образом, результаты проведенных лабораторных испытаний могут стать основой для разработки технологической схемы металлизации шлака с последующим его использованием для цементационного выщелачивания меди из кислотных растворов (отработанного медного электролита). Такой подход позволит заменить дефицитный и дорогой железный скрап, используемый для нейтрализации электролита на доступное сырье – собственные отходы.

