Оксидные системы состава MMe2O4 (M – Ni2+, Cu2+, Zn2+, Me – Fe3+, Cr3+) являются примером материалов, сочетающих важные технологические свойства. Так, например, ферриты переходных металлов со структурой шпинели используются в качестве магнитных, электрических материалов [1, 9], оксидные системы на основе хромитов – как катализаторы ряда реакций [7]. Технологические операции синтеза таких соединений требуют, как правило, использования высокотемпературной термообработки и сложного аппаратурного обеспечения. При этом применяют как традиционные методы – керамический (из оксидов металлов), так и вошедшие в практику относительно недавно. Например, при синтезе феррита никеля (II) используют гидротермальные методы [5], микроволновое воздействие [3]. Внимание химиков-синтетиков концентрируется на разработке новых методик получения ферритов и хромитов переходных материалов с заданным комплексом свойств. Характерной тенденцией последнего времени стало стремление к миниатюризации получаемых объектов. Для синтеза мелкокристаллических шпинелей широко используют метод разложения солей в матрице органического компонента реакционной смеси, в качестве которого используют глицин [6], этиленгликоль [4], лимонную кислоту [9] и другие.
Целью данной работы являлось изучение возможности формирования структуры шпинели с развитой поверхностью для образцов с различной технологической предысторией на примере ферритов и хромитов состава MМе2O4 (M – Ni, Cu, Zn; Me – Fe, Cr).
Материалы и методы исследования
Для приготовления образцов были использованы несколько технологических приемов:
1. Смешивали растворы сульфатов железа (III), хрома (III), никеля (II), меди (II) с концентрацией 0.5 – 1.5 моль/л, выпаривали полученный раствор на песчаной бане, высушивали и подвергали ступенчатой термообработке при температурах 500 – 600 – 700 – 800 – 900°С с выдержкой при каждой указанной температуре в течение 0.5 – 1.5 часов (образец 1);
2. Смешивали растворы указанных солей с раствором лимонной кислоты с концентрацией 6.0 – 7.0 моль/л, высушивали при температуре 100°С и подвергали ступенчатой термообработке при температурах 500 – 600 – 700 – 800°С с выдержкой при каждой указанной температуре в течение 0.5 – 1.5 часов (образец 2);
3. Смешивали растворы нитратов переходных металлов с концентрацией 0,5 – 1,5 моль/л, помещали в водный раствор аммиака, затем добавляли водный раствор полиакриламида (ПАА) и подвергали термообработке до полного разложения органической составляющей (образцы 3–6). Более подробно методика приведена в [2]. В ходе протекающей реакции наблюдали выделение газов, свечение. Образцы имели вид мелкокристаллических порошков.
Состав образцов и условия синтеза приведены в табл. 1.
Таблица 1
Состав, условия проведения синтеза и значения площади поверхности образцов
|
№ образца |
Состав образца |
Условия синтеза |
Значения SВЕТ, м2/г |
|
1 |
Ni0.3Cu0.7Fe0.6Cr1.4O4 |
Разложением солей |
1,4 |
|
2 |
Ni0.3Cu0.7Fe0.6Cr1.4O4 |
Разложением солей в лимонной кислоте |
3,4 |
|
3 |
Ni0.3Cu0.7Fe0.6Cr1.4O4 |
Разложением солей в ПАА |
15,9 |
|
4 |
NiFe2O4 |
Разложением солей в ПАА |
26,2 |
|
5 |
ZnFe2O4 |
Разложением солей в ПАА |
207,3 |
|
6 |
CuCr2O4 |
Разложением солей в ПАА |
29,8 |
Микрофотографии образцов были получены на сканирующем электронном микроскопе на базе кафедры неорганической химии 1 (Технический университет г. Дрезден (Германия)) и в ЦКП «Нанотехнологии» Южно-Российского государственного политехнического университета (НПИ) имени М.И. Платова.
Изотермы физической адсорбции азота были получены при 77 K, на аппарате Quantachrome Autosorb 1c на базе кафедры неорганической химии 1 (Технический университет г. Дрезден (Германия)) (до измерения образцы были дегазированы в вакууме при 150 °С в течение 20 ч. Определение площади поверхности проводили, используя уравнение ВЕТ (p/p0 = = 0.05–0.2)) и на аппарате ChemiSorb 2750 в ЦКП «Нанотехнологии» Южно-Российского государственного политехнического университета (НПИ) им. М.И. Платова.
Результаты исследования и их обсуждение
При анализе данных рентгенофазового анализа можно отметить, что образец 1 содержит три фазы: твердый раствор, кристаллизующийся в структуре кубической шпинели; делафоссит CuCrO2 (Cu2Cr2O4), кристаллизующийся в ромбоэдрической симметрии; оксид меди (II). На рис. 1 приведены фрагменты рентгенограммы образца (линия № 1). На рентгенограммах показаны линии, соответствующие кубической фазе шпинели (обозначены индексами 220, 311), фазе делафоссита (обозначены индексами 006, 101, 012).
Формирование фаз в системе после разложения сульфатов металлов на оксиды серы (VI) и соответствующего металла, по-видимому, может быть описано реакциями:
NiO + Fe2O3 = NiFe2O4 (1)
0.18 CuO + 0.18 Cr2O3 = 0.18 CuCr2O4
0.18 CuO + 0.18 CuCr2O4 =
0.18 Cu2Cr2O4 + 0.09 O2 (2)
0.31 CuO + 0.52 Cr2O3 = = 0.52Cu0.6□0.4CrVI0.27CrIII1.73O4
0.3NiFe2O4 + 0.52Cu0.6□0.4CrVI0.27CrIII1.73O4 =
= 0.82 Ni0.37Cu0.38□0.25Fe0.73CrVI0.17CrIII1.10O4.
Анализ профилей линий, характеризующих фазу кубической шпинели (рис. 1) показывает, что образующийся твердый раствор соответствует ферриту никеля (II), легированному катионами меди и хрома. Следует предположить, что в первую очередь образуется NiFe2O4 в соответствии с уравнением (1) преимущественно за счет диффузии катионов Fe3+. Далее следует образование хромита меди (II) за счет диффузии катионов меди. По достижении температуры термообработки 900 °С начинает протекать реакция, описываемая уравнением (2) аналогично наблюдаемому в [8]. Оставшаяся часть оксидов хрома (III) и меди (II) взаимодействует с образованием промежуточного соединения – дефектного хромита меди, в состав которого, по-видимому, входят катионы хрома в шестивалентном состоянии и имеются вакансии в катионной подрешетке (обозначены □). На заключительной стадии синтеза протекает процесс образования твердого раствора со шпинелеподобной структурой.
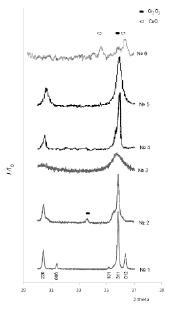
Рис. 1. Рентгенограммы образцов. Индексированы линии, принадлежащие шпинели (220, 311) и фазе делафоссита (006, 101, 012)
Рассчитанные значения SВЕТ для синтезированных соединений приведены в табл. 1. Полученный материал имеет зерна округлой формы с размерами от 140 нм до 1.65 мкм (рис. 2, а).
Образец 2 состоит из кластеров, соответствующих: твердому раствору, кристаллизующемуся в структуре кубической шпинели; тетрагональной шпинели на основе CuCr2O4; оксиду хрома (III). На рис. 1 приведена часть рентгенограммы образца (линия № 2). Пик в области значений 2θ ≈ 33.6 градусов характеризует, вероятно, оксид хрома (III), образовавшийся в ходе реакции разложения солей.
Полученный материал имеет мелкие октаэдрические зерна с размерами от 95 нм до 0.45 мкм (рис. 2, б). Значения SВЕТ для него (табл. 1) более чем в 2 раза выше, чем у образца 1.
На рентгенограмме образца 3 присутствуют линии, соответствующие твердому раствору, кристаллизующемуся только в структуре шпинели. На рис. 1 приведена часть рентгенограммы образца (линия № 3).
В ходе термообработки смеси исходных веществ протекает процесс разложения солей с образованием оксидов, которые взаимодействуют по схеме:
0.7 CuO + 0.7 Cr2O3 = 0.7 CuCr2O4,
0.3 NiFe2O4 + 0.7 CuCr2O4 = Ni0.3Cu0.7Fe0.6Cr1.14O4.
Полученный материал имеет неоформившуюся структуру с включениями мелких кристаллов с размерами приблизительно от 80 до 170 нм (рис. 2, в) и характеризуется более высоким значением SВЕТ по сравнению с образцами 1 и 2 (табл. 1).
Из анализа рентгенограммы образца 4 (рис. 1, линия № 4) следует, что основной фазой является шпинель состава NiFe2O4. В следовых количествах присутствует Fe2O3. Материал высокопористый (рис. 2, г), с развитой поверхностью.
На рентгенограмме образца 5 присутствуют только линии, характеризующиеся фазу феррита цинка в кубической модификации (рис. 1, линия № 5). Материал имеет наиболее развитую поверхность из изученных образцов (рис. 2, д). Значение площади поверхности SВЕТ = 207 м2/г.
0.3 NiFe2O4 + 0.7CuCr2O4 = = Ni0.3Cu0.7Fe0.6Cr1.4O4.

Рис. 2. Микрофотографии образцов: а – образец 1; б – образец 2; в – образец 3; г – образец 4; д – образец 5; е – образец 6
На рентгенограмме образца 6 (рис. 1, линия № 6) выявлены линии, соответствующие шпинели состава CuCr2O4. Ее количество составляет порядка 10 %. Основными фазами являются оксиды CuO и Cr2O3.
Фазообразование в системе, по-видимому, может быть описано следующими реакциями:
Cu(NO3)2 = CuO + 2 NO2 + 1/2 O2
2 Cr(NO3)3 = Cr2O3 + 6 NO2 + 3/2 O2
CuO + Cr2O3 = CuCr2O4
В полученном образце фаза шпинели окристаллизована недостаточно для анализа параметров решетки. Материал высокопористый (рис. 1, е).
Таким образом, следует отметить, что при изменении технологической предыстории возможно образование образцов шпинелей с различным характером поверхности. Как следует из данных рис. 3 и табл. 1, в ходе реакции разложения солей образуется высокопористый материал.
В результате проведенного исследования можно отметить следующие особенности.
1. Наиболее высокими значениями площади поверхности характеризуются образцы, полученные при разложении солей в присутствии органического компонента. Значения SВЕТ для таких материалов в некоторых случаях более чем в 100 раз выше, чем у образца, полученного разложением сульфатов металлов.
2. Использование в качестве органической составляющей раствора полиакриламида приводит к формированию образцов с более развитой поверхностью (площадь поверхности увеличивается в 4-60 раз), по сравнению с материалами, полученными при введении лимонной кислоты.
3. С применением описанной методики не удается синтезировать хромит меди (II). Образование ферритов никеля (II) и цинка, а также твердых растворов на основе сложных оксишпинелей протекает практически полностью.
4. На формирование образцов с развитой поверхностью, по-видимому, оказывает влияние природа двухвалентного катиона. Так, при формировании феррита никеля (II) удается получить материал с практически полностью сформированнй структурой шпинели, при этом значения SВЕТ для него выше, чем у феррита-хромита никеля (II)-меди (II), полученного в аналогичных условиях, на 39 %. Однако образец с наиболее развитой поверхностью из рассматриваемых формируется в системе ZnO-Fe2O3.
Выводы
На основе сравнительной оценки различных технологических операций синтеза шпинелей выявлено, что формирование структуры образцов наиболее полно протекает для ферритов переходных элементов, в том числе – при частичной замене катионов Fe3+ катионами Cr3+ в составе твердого раствора.
Введение в процессе гомогенизации смеси органической составляющей способствует формированию образцов с более развитой поверхностью. При этом образцы, при получении которых использовали раствор полиакриламида, обладают более развитой поверхностью, чем полученные в среде лимонной кислоты.
Высказано предположение о существенной роли катиона двухвалентного металла в формировании образцов с развитой поверхностью. Синтезированный материал со структурой кубической шпинели состава ZnFe2O4 имеет площадь поверхности 207 м2/г.

