Саркомы мягких тканей представляют большую группу опухолей мезенхимального происхождения, различных по клиническим и морфологическим признакам. На их долю приходится около 2 % в структуре онкопатологии. Статистика последних лет свидетельствует о неуклонном росте заболеваемости и смертности от сарком мягких тканей [2, 4, 9].
Общим для многообразия клинико-морфологических форм сарком мягких тканей является крайне агрессивное течение, характеризующееся многократным рецидивированием, гематогенным метастазированием, определяющим неблагоприятный прогноз заболевания.
Лечение больных саркомами мягких тканей – одна из сложных проблем современной онкологии, над разрешением которой работают и хирурги, и радиологи, и химиотерапевты. Несмотря на разработку различных приемов лучевого воздействия на опухоль, бурное развитие химиотерапии с применением все более современных препаратов, различных их комбинаций и способов введения, хирургический компонент в лечении сарком мягких тканей остается основным.
Строгое следование принципам хирургического радикализма в ходе операций по удалению опухолей мягких тканей приводит к образованию обширных раневых дефектов. Кроме того, при упорно рецидивирующих опухолях предшествующее хирургическое и лучевое воздействие создает неблагоприятный фон для удаления опухоли и пластического закрытия раневого дефекта. Особенностью лечения таких больных заключается в выполнении расширенных, нередко комбинированных вмешательств [5, 7, 8].
Анализ основных тенденций развития онкологии убедительно показывает практическую необходимость в использовании современных технологий пластической хирургии в общей схеме лечения онкологических больных. В частности, хирургический метод развивается по пути реконструктивно-пластического устранения анатомо-функционального дефекта, возникшего при противоопухолевом лечении. Пластическое восполнение послеоперационного дефекта дает возможность более широкого иссечения опухоли, тем самым увеличивая радикальность хирургического вмешательства. Кроме того, адекватное замещение дефектов, образующихся в результате удаления новообразований, исключает значительное натяжение краев раны, которое может повлечь развитие краевого некроза кожи с расхождением краев раны и длительным ее заживлением, отсрочить другие этапы лечения [6, 10].
В настоящее время практически нет разногласий о целесообразности восстановления тканей после удаления злокачественных опухолей мягких тканей и других новообразований наружных локализаций, когда отсутствует возможность закрытия послеоперационной раны без использования дополнительного пластического материала. Гипотеза о повышенной чувствительности кожного трансплантата к поражению опухолевым процессом и о том, что пластическое замещение раневого дефекта после удаления опухоли способствует развитию местных рецидивов, не нашла клинического подтверждения [3].
Более того, отказ от восстановления тканей ведет к сужению границ иссечения опухоли, что является одной из основных причин увеличения частоты локальных рецидивов. Данные авторы убедительно показали, что подобные операции заметно улучшают результаты хирургического лечения больных с далеко зашедшими и рецидивными опухолями. Отмечено, что наиболее рациональна именно одномоментная с удалением опухоли пластика, которая обеспечивает быстрое заживление раны, сокращает длительность послеоперационного периода, предупреждает развитие уродующих рубцов и контрактур. Использование многоэтапных и отсроченных пластических операций малорационально, требует длительного времени и задерживает продолжение специального лечения.
Безусловно, на первом месте должна стоять задача максимально надежного излечения больного от злокачественного новообразования. Это означает, что любые восстановительные операции должны быть спланированы и произведены таким образом, чтобы не нарушать основную лечебную программу. С другой стороны, результат пластики тканевого дефекта должен быть изначально заложен в лечебную тактику.
Исходя из вышеизложенного, концепция единого лечебно-реабилитационного комплекса лечения онкологических больных, предусматривает следующие основные положения:
В данной статье мы хотим привести клинический пример успешного хирургического лечения больной с распространенной дерматофибросаркомой мягких тканей, развившейся на фоне рецидивирующего нейрофиброматоза. Реконструктивно-пластический компонент явился завершающим этапом хирургического вмешательства, поскольку простое ушивание краев раны без использования дополнительного пластического материала не представлялось возможным из-за размеров раневого дефекта, трофических, рубцовых изменений тканей после предшествующих многократных операций.
Дерматофибросаркома выбухающая – злокачественная мезенхимальная опухоль кожи. Встречается в 0,01 % случаев среди всех злокачественных опухолей и 2–6 % среди опухолей мягких тканей. Опухоль встречается редко, поражает лиц мужского и женского пола. Дерматофибросаркома возникает обычно у взрослых, наиболее часто между 30 и 40 годами, чаще у мужчин, но может быть и у детей. Располагаться может на любом участке кожного покрова, но чаще на туловище.
В большинстве случаев обладает медленным ростом, возможно изъязвление, выражена склонность к рецидивированию (до 30–50 %). Практически не метастазирует, только после многих лет существования, в регионарные лимфатические узлы, легкие, мозг, кости.
Для фибробластических сарком неизвестны предопухолевые (диспластические) процессы и случаи трансформации из доброкачественных опухолей. Единственным исключением здесь является выбухающая дерматофибросаркома кожи, которая после некоторых рецидивов трансформируется в «классическую» фибросаркому взрослых [1].
Больная Д, 55 лет, поступила в отделение «Опухолей мягких тканей и костей» РНИОИ в сентябре 2012 года с жалобами на наличие изъязвлённой экзофитной опухоли мягких тканей паховой области справа с переходом на брюшную стенку, правую половину лобка и верхнюю треть правого бедра.
Из анамнеза: болеет с 1985 года, когда впервые был установлен диагноз «рецидивирующий нейроброматоз правой паховой области». В последующем неоднократно оперирована по месту жительства, но болезнь многократно рецидивировала, и распространилась на соседние анатомические зоны, появились язвы, мокнутие, боли. В 2010 году в Московском НИИ онкологии им. Герцена морфологически верифицирована, гистологическое заключение: дерматофибросаркома. На момент обращения процесс расценен как нерезектабельный, рекомендована химиотерапия по схеме САРО. По месту жительства проведено 7 курсов ХТ по рекомендованной схеме. В результате лечения язвы немного «подсохли», уменьшились боли. Осенью 2012 года обратилась в Ростовский НИИ онкологии. Локальный статус: в правой паховой области с переходом на бедро, правую подвздошную область, лобок, правую большую половую губу располагается множество экзофитных опухолей, одиночных и сливающихся между собой, размерами от 1 до 10 см. Часть опухолевых узлов изъязвлена, с мокнутием, скудным серозным отделяемым. Кожа пораженной зоны с рубцовыми послеоперационными изменениями. Регионарные лимфоузлы не увеличены (рис. 1). При обследовании опухолевых изменений в других органах и системах не выявлено. Госпитализирована в отделение для хирургического лечения. 20.09.2012 выполнена радикальная операция в объеме: широкое иссечение опухоли с резекцией правой большой половой губы с пластикой дефекта перемещенными кожно-жировым лоскутом передней брюшной стенки, умбиликопластика (рис. 3, 4). Раневой дефект составил 31,0х42,0 см (рис. 2). Гистологическое заключение: G1 выбухающая дерматофибро-саркома, удалена в пределах здоровых тканей. Послеоперационный период осложнился некрозом 1/4 дистальной части перемещенного лоскута. Выполнена некрэктомия, хирургическая обработка грануляций с пересадкой свободного расщепленного аутодермотрансплантата с гомолатерального бедра. В послеоперационном периоде продолжены курсы ХТ. При контрольной явке спустя год после операции данных за рецидив и метастазы не выявлено (рис. 5).
Для закрытия дефекта мягких тканей после широкого иссечения опухоли у данной больной нами был использован кожно-жировой лоскут на питающей сосудистой ножке. Принимая во внимание расположение питающих сосудов, можно перемещать большие кожно-жировые массивы на ножке и закрывать значительные по величине дефекты. К пластике лоскутом на ножке особенно применим принцип совмещения тщательного планирования операции и учета всех индивидуальных особенностей данной анатомической зоны.
Пластику лоскутом на ножке, образованным поблизости от дефекта, производят в тех случаях, когда по соседству имеется достаточное количество хорошо смещаемой кожи, из которой можно позаимствовать лоскут значительных размеров. Принимая во внимание расположение питающих сосудов, можно перемещать большие кожно-жировые массивы на ножке и закрывать значительные по величине дефекты. К пластике лоскутом на ножке особенно применим принцип совмещения тщательного планирования операции и учета всех индивидуальных особенностей данной анатомической зоны.
Разветвленная сосудистая сеть в подкожной жировой клетчатке определяет возможность использования кожно-жировых лоскутов. В зависимости от микрососудистой анатомии и конкретных условий они могут быть использованы в виде лоскутов на ножке, и как кровоснабжаемые аутотрансплантаты. Обычно его нижняя поверхность представлена слоем подкожной жировой клетчатки с подкожным сосудистым сплетением, располагающимся на уровне поверхностной фасции, разделяющей подкожную жировую клетчатку на поверхностный (более плотный) и глубокий (более рыхлый) слои. Это сосудистое сплетение наиболее развито на туловище и нижних конечностях. Пластичность лоскута зависит от его толщины, жировая клетчатка способна заполнять неглубокие «карманы», однако плотность микрососудистой сети в ней относительно невысока. Способность к неоваскуляризации низкая. Доказанная антибактериальная активность ниже, чем фасции и мышцы. К преимуществам кожно-жировых лоскутов относится, прежде всего, возможность создания полноценного кожного покрова при обширных дефектах тканей. Показания к их пересадке возникают в тех случаях, когда дефект тканей не может быть качественно закрыт с помощью простых кожных трансплантатов.
При выкраивании лоскутов мы руководствовались типичными разрезами с учетом прохождения сосудистых ветвей, естественных кожных складок, соотношением длины и ширины лоскута 1|:|3 и 1|:|4. Вершину лоскута формировали острой или слегка закругленной, от вершины к основанию лоскут постепенно утолщался, в основание ножки включали достаточное количество мягких тканей с проходящими в них сосудами. Не допускали ротацию лоскутов под большим углом (более 90 °), что вызывает чрезмерное растяжение сосудов питающей ножки и их сдавление.
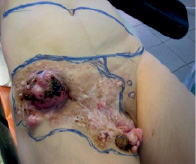
Рис. 1. Вид больной с разметкой
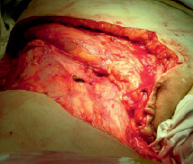
Рис. 2. Вид раневого дефекта после удаления опухоли
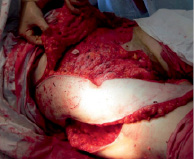
Рис. 3. Этап перемещения лоскута
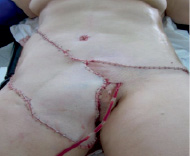
Рис. 4. Окончательный вид послеоперационной раны после ушивания
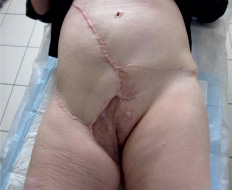
Рис. 5. Общий вид зажившей раны через 6 мес. после оперативного вмешательства
На современном этапе развития хирургической техники и медицины в целом, улучшение результатов хирургического лечения больных опухолями мягких тканей не должно ограничиваться рамками онкологических показателей. Эстетико-функциональные аспекты проблемы могут и должны решаться путем индивидуального подхода к выбору метода кожной пластики, в зависимости от размеров и локализации первичного очага.
Таким образом, дифференцированный подход к способам закрытия обширных мягкотканных дефектов позволил провести радикальное иссечение очага поражения с получением хорошего функционально-эстетического результата. Наиболее надежными способами пластического закрытия ран следует считать перемещение лоскутов на питающей ножке. Индивидуализированный подход к выбору методики для пластического закрытия послеоперационного дефекта в зависимости от локализации опухоли допускает иссечение обширных участков кожи, что повышает радикальность хирургического вмешательства, позволяет избежать осложнений, связанных с натяжением краев раны, улучшая тем самым качество жизни больных и ускоряя медицинскую реабилитацию.

