Гемангиомы новорожденных являются наиболее частой опухолью этого периода [4]. Гемангиомы являются доброкачественными сосудистыми аномалиями и представляют собой опухоли, исходящие из гиперплазированного эндотелия. В своем развитии гемангиомы проходят две фазы: пролиферативную и инволютивную. Пролиферативная фаза развития характеризуется прогрессивным ростом опухоли, что обусловлено наличием рыхлых, быстро делящихся эндотелиальных клеток, формирующих массу синусоидальных сосудистых каналов. Последующая регрессия связана с постепенным снижением эндотелиальной активности, редукции ангиогенеза, гибелью эндотелиальных клеток, расширением васкулярных каналов. Опухоль принимает лобулярную архитектонику, замещаясь фиброзо-жировой стромой и мелкими капиллярами. [4].Основными направлениями лечения гемангиом является системное воздействие на ангиогенез и локальное опухолевую ткань. Фотохромотерапия (ФХТ) удовлетворяет этим требованиям. [1].Однако патогенез гемангиомы у детей раннего возраста при этом виде терапии все еще не изучен. Известен метод культивирования эксплантатов опухолей в диффузионных камерах. Метод был разработан для изучения особенностей пролиферативного статуса клеток злокачественных и доброкачественных опухолей [2, 3, 5, 6, 8]. С целью изучения состояния клеток гемангиом на этапах ФХТ изучить возможности метода культивирования эксплантатов опухоли в диффузионных камерах.
Материалы и методы исследования
В эксперименте использовали 10 животных, возрастом 16–17 недель, весом 210 ± 50 г при их равном числе в контрольной и опытной группах. Культивирование клеток гемангиомы в эксперименте провели суспензией клеток, используя диффузионные камеры (ДК) [5, 8]. Все работы с опухолевой тканью проводили в стерильных условиях в ближайшие 3–4 часа после выделения фрагментов опухоли из операционного материала. Морфологической формой во всех экспериментах была гемангиома. Участки опухоли, полученные из операционного материала больных детей, очищали от некроза, рассекали стерильными глазными ножницами на более мелкие фрагменты, диаметром 0,2 мм3, в стерильной чашке Петри, содержащей физиологический раствор с добавлением 10000 ед./мл пенициллина. Затем эти кусочки повторно измельчали с помощью стерильного гомогенизатора и инкубировали при + 37 °С в забуференном солевом растворе (рН – 7,2), содержащем 4 мг коллагеназы, 20 мг трипсина и 10 мг ДНК-азы на 20 мл инкубационной среды 199, при постоянном перемешивании на магнитной мешалке. Такая процедура повторялась 5-кратно по 15–20 минут. После окончания каждого цикла ферментативной обработки получали порции клеток, которые в дальнейшем объединяли. Действие ферментов инкубировали добавлением солевого раствора, содержащего 10 % человеческой сыворотки, инактивированной нагреванием. Выделенные клетки отмывали центрифугированием при 1500 g в культуральной среде 199 и затем подсчитывали. Подсчет концентрации клеток клеточной суспензии и их жизнеспособности осуществляли в камере Горяева после добавления раствора суправитального красителя, представляющего собой приготовленную ex tempore смесь 4 частей 0,2 %-го р-ра трипанового синего и 1 части 4,25 %-го раствора NaCl. Клеточную суспензию, содержащую 500 тыс. опухолевых клеток в объеме до 0,1 мл, наносили с помощью микродозатора на большой фильтр. После этого монтировали собственно камеры и помещали их в стерильные чашки Петри, содержащие среду 199 комнатной температуры, где они находились до момента имплантации животному – реципиенту. Для изготовления ДК применяли мембранные фильтры «Сынпор» (производство Чехия) с диаметром пор 0,23 мкм. Фильтры монтировали на кольцах из тефлона большого и малого диаметра с наружными диаметрами соответственно 18 и 14 мм и шириной колец 2 мм при высоте 2 мм, пользуясь клеем БФ-6. Использовали стерильные ДК, обработанные в течение 2 ч ультрафиолетовым излучением.
Под эфирным наркозом осуществляли имплантацию камер в асептических условиях. После обработки операционного поля 5 %-м спиртовым раствором йода проводили срединную лапаротомию (длина разреза 2–2,5 см). В брюшную полость крысы имплантировали до 3 ДК. Их располагали на петлях кишечника. Брюшную полость ушивали послойно двухрядным непрерывным швом наглухо. Клетки культивировали в течении 7 суток.
Животные с ДК были разделены на две равные группы. Первая группа контроля, материал от детей с гемангиомами без лечения. Вторая группа – дети после шести курсов ФХТ. На 7 сутки эксперимента животных забивали под эфирным наркозом, извлекали ДК, очищали их наружную поверхность от перитонеальных клеток. Опухолевые клетки после демонтажа ДК вместе с подлежащим фильтром фиксировали в 96 ° спирте в течение 20 мин, затем проводили через спирты с понижающейся концентрацией (70, 50 ° по 10 мин), окрашивали в течение 15 мин гематоксилином Карраччи, проводили через спирт возрастающей концентрации (60, 70, 80, 96, 100 ° по 5 мин) просветляли в ксилоле и заключали в канадский бальзам, получая тотальные гистологические препараты.
Для характеристики опухолевого роста использовались следующие морфологические критерии: деструкция опухолевых клеток, отсутствие миграции клеток из эксплантата; миграция единичных опухолевых клеток, расселение опухолевых клеток по фильтру и образование монослоя различной плотности; наличие конгломератов клеток; образование сфероидов (7).
Для оценки пролиферативной активности опухолевых клеток использовали такие критерии, как индекс эффективности сфероидообразования (ИЭС) [2, 3].
Расчет ИЭС, выраженного в процентах, осуществляли по формуле
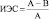 ,
,
где А – среднее количество сфероидов в контрольной группе, В – среднее количество сфероидов в опытной группе. Положительные значения ИЭС соответствуют ингибиции формирования сфероидов, т.е. проявлению противоопухолевого действия, отрицательные значения индекса свидетельствуют об ускорении роста опухоли.
Результаты исследования и их обсуждение
Исследование особенностей роста эксплантатов сосудистых опухолей при их культивировании в ДК выявило определенные отличия. Рост эксплантатов опухолей в контроле характеризовался выраженной интенсивностью: определялась активная миграция клеток из эксплантатов, расселение их по всему фильтру диффузионной камеры, образование разных по размеру участков монослоя низкой и средней плотности; наблюдались этапы образования конгломератов клеток. На 7 сутки культивирования в контроле на поверхности миллипоровых фильтров ДК было отмечено формирование многослойных колониеподобных структур – сфероидов, состоящих из округлых или удлиненных клеток, ориентированных по спирали вокруг центра такого образования. Границы этих организованных клеточных скоплений обычно были четко очерчены. Между ними располагались относительно немногочисленные изолированные эпителиоциты в монослое и единичные фибробласты. В монослое и сфероидах клетки были полиморфными в основном крупными округлыми или веретенообразными, ядра нередко имели продолговатую форму, встречались двуядерные варианты и «голые ядра». Было подсчитано, что клетки на фильтре в контроле образуют 20,25 ± 3,12 сфероидов, ИЭС-отриц. Определялась высокая митотическая активность клеток сосудистой опухоли (от 4 до 10 фигур митоза в различных полях зрения), патологические митозы встречались в половине случаев от общего числа митозов (рис. 1, 3).
Во второй опытной группе отличие от контроля рост эксплантатов был незначительным, наблюдали только миграцию единичных клеток вокруг эксплантата и лишь в одном случае начальные этапы образования монослоя. Общая морфологическая картина культивированных в ДК клеток значительно отличалась. Определялись единичные сфероиды и только в одном случае, ИЭС имел положительное значение, что свидетельствовало об ингибирующем действии ФХТ на процессы сферообразования. В структуре существующих сфероидов отмечалось значительное обеднение их эпителиоцитами, наблюдали дистрофические изменения в них. Митотическая активность снижена, чаще выявляли патологические митозы. Большинство клеток имели отростки и по своей структуре напоминали фибробласты. Клетки гемангиомы не были идентифицированы (рис. 2, 4).
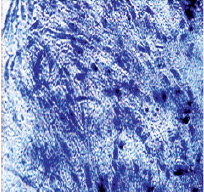
Рис. 1. Клетки культуры эксплантатов гемангиомы ребенка без ФХТх400
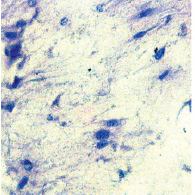
Рис. 2. Клетки культуры эксплантатов гемангиомы ребенка после ФХТх400
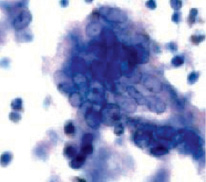
Рис. 3. Сфероиды в культуре эксплантатов гемангиомы детей без ФХТх1000

Рис. 4. Фибробласты в культуре эксплантатов, клетки гемангиомы не опеделяются. х1000
Заключение
Таким образом, результаты настоящих исследований и данные, полученными нами ранее, позволяют прийти к заключению, что после шести курсов ФХТ в операционном материале, взятом на месте гемангиомы, и культивированном в ДК опухолевые клетки не присутствуют.

