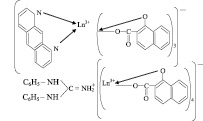
Большой интерес, проявляемой в настоящее время к химии гидроксинафтоатов РЗЭ, а также их смешаннолeгандных комплексов с различными нейтральными дополнительными легендами, обьясняется широкими возможностями их применения в различных научных и практических целях.
Данные об РЛК гидроксинафтоатов РЗЭ в литературе отсутствует; принципиальная возможность образования таких соединений не изучено цель нашой работы являлась разработка метода синтеза и определения условий выделения в твердом виде устойчивых РЛК ОНК, установление их свойства и состава различными методами.
Ионы редкоземельных элементов (РЗЭ) способны к образованию смешанных комплексов с бидентатными легендами (β-декатоннами, салициловой кислотой и др.) и рядом азотосодержащих органических оснований (1,10-фенантролин, 2,2’-дипиридил, антипирин, анилин, дифенилгуанидин, пиридин и др.) [1–3]. Нами выяснялись возможности образования комплексов РЗЭ подобного типа с бидентатным лигандом-1-гидрокси-2-нафтойной кислотой (ОНК) предложенной для разделения многих элементов [4–6]. В качестве оснований были взяты 1,10-фенантролин (о-ФЕН), дифенилгуанидин (ДФГ). Свойства и состав экстрагируемых хлороформом комплексов были изучены спектрофотометрический на примере неодима и эрбия: ионы этих элементов обладают полосами поглощения в видимой части спектра, структура и интенсивность которых значительно изменяются в зависимости от состава комплекса. Кроме того, был проведен химический анализ соединений, выделенных из растворов в твердом виде.
Материалы и методы исследования
Растворы и реагенты. Раствор с концентрацией 0,1 мг/мл неодима и эрбия приготовлен из нитратов неодима и эрбия (х. ч.). Более разбавленные растворы готовят разбавлением. Концентрацию раствора установила комплексон метрически .
Растворы 1,10-фенантролин (ФЕН) (0,1–0,04 М) и дифенилгуанидина (0,05 М) готовила растворением навесок соответствующих веществ в воде, при добавлении соляной кислоты до рН 4-5. Использовано 1-гидрокси-2-нафтойная кислота (ОНК) очищена двух кратным пере осаждением из насыщенного этонaльнoго раствора водой и высушены при 90 °С.
В качестве исходного раствора ОНК использован в виде 0,05–0,08 М хлороформе, 0,25 М раствора в этаноле. Все остальные использованные реагенты и растворители имели квалификацию «х. ч.» не подвергались дополнительной очистке. Во всех опытах постоянную ионную силу (µ = 0,1) поддерживали с помощью рассчитанного количества 1 М раствора КNО3 Регистрацию спектров поглощения растворов комплексов производили с помощью спектрофотометра типа СФ-26, рН контроливали при лабораторном рН-метре, рН-673 со стеклянной электродом.
Результаты исследования и их обсуждения
Предварительные опыты показали, что в слабокислых и щелочных растворах (рН 5,5–9,5) нитраты РЗЭ и ОНК образуют хлопьевидные комплексы.
Условия образования и экстракции комплекса. Для получения экстрактов комплексов смешивали в делительной воронке водные растворы нитратов РЗЭ, о-фенантролин или дифенилгуанидин 5 мл 2 М хлорида аммония, доводили объем раствора водой до 15 мл, взбалтывали с 5 мл хлороформного раствора 1-гидрокси-2-нафтойной кислоты и по каплям добавляли разбавленный раствор аммиака, перемешивая каждый раз. После получения примерно заданного значения рН (7-9,5), растворы дополнительно перемешивали 3-4 мин; затем их разделили и фильтровали через складчатый фильтр.
С помощью рН-метра устанавливали точное значение рН водного раствора. Производили запись спектра хлороформного раствора комплекса в кювете l = 0,5 см, используя специальные кювет держатели с диафрагмами [7]. Спектров поглощения хлороформных растворов 1-гидрокси-2- нафтойных комплексов неодима и эрбия в присутствии и отсутствии оснований в области нахождения «чувствительных» к полю легендой полос поглощения (Nd 560–620 м и Er 510-550 нм) приведены на рис. 1. Соотношение компонентов в водных растворах составляло 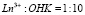 или
или 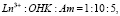 (Am = o – ФЕН, ДФГ)
(Am = o – ФЕН, ДФГ) 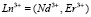 . рН раствора водного слоя после экстракции – 8,0–8,5.
. рН раствора водного слоя после экстракции – 8,0–8,5.
Как видно из рис. 1 спектры растворов 1-гидрокси-2-нафтойных комплексов в отсутствия и в присутствии оснований отличаются друг от друга, причем для комплексов неодима в большей степени, чем для комплексов эрбия. В присутствии оснований расщепление полосы поглощения растворов комплексов неодима в области 560–620 нм усиливается, причем более значительно в том случае, когда в качестве основания был взят дифенилгуанидин. Наблюдается некоторое увеличение интенсивности полос поглощения, также более значительное в присутствии ДФГ. Сдвига максимума полосы поглощения (λ = 590 нм) не происходит, однако максимум при λ = 590 нм становится более интенсивным.
Максимумы полос поглощения растворов 1-гидрокси-2-нафтойных комплексов эрбия сдвигаются в сторону больших длинных воли в присутствии о-фенантролина или дифенилгуанидина. Эти изменения свидетельствуют об образовании новых комплексных которых входят все три компонента: металл, 1-гидрокси-2-нафтойная кислота и основание (0-ФЕН или ДФГ).
Для установление оптимальных значений рН раствора, при которых образуются смешанные комплексы, и происходит их экстракция органическим растворителем, были получены графики зависимости оптической плотности в максимумах полос поглощения гидроксинафтойных комплексов в присутствии и отсутствии оснований от рН раствора.
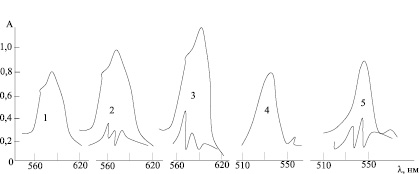
Рис. 1. Светопоглощение хлороформных экстактов 1-гидрокси-2-нафтоатных комплексов неодима (1–3) и эрбия (4–5) в отсутствие основания (1–4) и в присутствие 0-фенантролина (2,5) и дифенилгуанидина (3,5). CLn = 4∙10-3 M; CAm = 0,02 M; COHK = 4∙10-2 M; pH 8,5 ±0 ,05; l = 0,4 sm. Нижние записи 2, 3, 5 получены диффенциальным методом
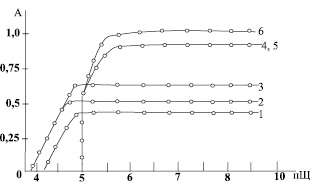
Рис. 2. Изменение оптической плотности хлороформных экстрактов комплексов эрбия (1–3) и неодима (4–6) в зависимости от рН, раствора в системах: Ln3+-ОНК (1, 4), Ln3+-ОНК-ФЕН (2, 5), Ln3+-ОНК-DФГ (3, 6). CLn = 6∙10-3 M; CAm = 2∙10-2 M; COHK = 6∙10-2 M; λNd = 590 нт; λEr = 510–520 нт; l = 0,5 sm. Нижние записи 2, 3, 5 получены диффенциальным методом
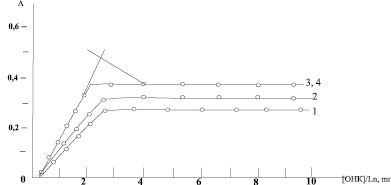
Рис. 3. Изменение оптической плотности хлороформных экстрактов в системе Ln-ОНК (1, 3) и Ln-ОНК-ФЕН (2, 4) при постоянной концентрации металла (3∙10-3 М) и 0-ФЕН (10-2 М) и переменной 1,2-эрбия, λEr = 510 нт; 3,4 – неодим, λNd = 590 нт; рН 8,5; l = 0,5 sm
Как видно из рис. 2 эти графики почти совпадают, если в образовании молекул комплексов принимали участие ионы неодима.
Экстракция комплексов начинается при рН 5,5 достигает максимума при рН 7 и остается постоянной при рН 7–9,5. При более высоких значениях рН образование и экстракция комплексов затруднены и требуется длительное перемешивание органического и водного слоев для полного их просветления. Смешанные гидроксинафтоатные комплексы эрбия независимо от рода основания, входящего в молекулы комплекса, начинают экстрагироваться при более низких значениях рН, чем сам 1-гидрокси-2-нафтойатных комплексов Er (4,60 и 4,80 соответственно). Однако максимум экстракций этих комплексов достигается при одном и том же значении рН раствора, равном 6,5, экстракция приблизительно постоянна при рН 6,5–9,5 (рис. 2).
Соотношение компонентов в гидроксинафтоатных комплексах неодима и эрбия, образующихся как в присутствии, так отсутствии основания было найдено спектрофотометрически методами молярных отношений и наклона логарифмических прямых [8]. Экстракцию комплексов проводили при тех значениях рН при которых оптическая плотность хлороформных экстрактов комплексов имеет максимальное значение (рис. 2).
Как видно из рис. 3, соотношение 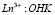 в двойном комплексе равно 1:3, в смешанном фенантролин-гидроксинафтоатном комплексе оно оказалось таким же.
в двойном комплексе равно 1:3, в смешанном фенантролин-гидроксинафтоатном комплексе оно оказалось таким же.
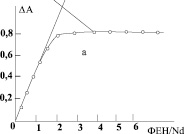
Для установления количества молекул о-фенантролина, входящих в молекулу смешанного комплекса, была использована дифференциальная запись спектров поглощения растворов серии (рис. 4, а).
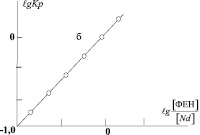
Соотношение  в молекуле комплекса было также подтверждено методом наклона логарифмических прямых [--]. По результатам опытов (рис. 4, а) строили график зависимости логарифма коэффициента распределения Кр комплекса неодима с ОНК и о-ФЕН от логарифма соотношения ФЕН:Nd в водном растворе (рис. 4, б).
в молекуле комплекса было также подтверждено методом наклона логарифмических прямых [--]. По результатам опытов (рис. 4, а) строили график зависимости логарифма коэффициента распределения Кр комплекса неодима с ОНК и о-ФЕН от логарифма соотношения ФЕН:Nd в водном растворе (рис. 4, б).
Кр рассчитывали по формуле:
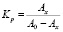 .
.
где Ах и А0 разностная оптическая плотность растворов в опыте и при избытке о-фенантролина соответственно. Тангенс угла наклoна полученной прямой равен 1, следовательно, в образовании молекулы смешанного комплекса неодима принимает участие одна молекула о-ФЕН.
Установить количество молекул o-ФЕН, входящих в состав аналогичного комплексов эрбия, спектрофотометрическим методом не удалось, так как величины разностной оптической плотности в этом случае малы. Соотношение ОНК:Ln3+ (в присутствии ДФГ) в молекуле смешанного комплексного соединения было найдено равным 3,5:1. Это может свидетельствовать об одновременной экстракции смешанного и простого комплексов.
Выделение комплексов РЗЭ с 1-гидрокси-2-нафтойной кислотой и органическими основаниями в твердом виде. Для выделения комплексов в твердом виде смешивали водные растворы нитратов РЗЭ, органического основания, хлорида аммония (5 ммол) и спиртовой раствор ОНК в количествах, соответствующих молярному соотношению Ln3+:ОНК: Ам=1:8:8, Ам=о-ФЕН, или ДФГ.
Затем медленно при перемешивании добавляли раствор аммиака (1:5) до рН 8–9. Раствор с осадком оставляли 2–3 ч при 6–10 °, осадок отфильтровывали промывали 3–4 раза холодной водой и высушивали до постоянного веса при 90 °.
Содержание РЗЭ выделенных соединений определяли комплексонометрически для чего навеску комплекса (30–40 мг) помешали в тигель, сжигали и прокаливали в муфельной печи при температуре 700–800 °, а полученную окись металла растворяли в соляной кислоте. Для определения содержания o-фенантролина и ОНК навеску комплекса растворяли в 10 мл хлороформа и раствор в делительной воронке встряхивали два раза (каждый раз в течение одной минуты) с 0,5 М соляной кислотой. При этом комплекс разрушался, о-ФЕН переходил в водный раствор, а ОНК оставалась в хлороформе. Определение о-ФЕН в солянокислых вытяжках производили фотометрический, используя его цветную реакцию с солями железа (II) [9].
а) б)
Рис. 4. Зависимости разностной оптической плотности от соотношения ФЕН:Nd для хлороформных растворов комплекса Nd-ОНК-ФЕН (а). Логарифмический график зависимости Кр неодима от соотношения [ФЕН]:[Nd]; CNd = 4∙10-3 M; CОНК = 4∙10-2 M; pН 8,5 (б)
Хлороформный раствор ОНК взбалтывали с 10 мл 0,2 М раствора ацетата натрия, содержащего хлорида железа (III) [10].По ярко-красный окраске образовавшегося комплекса в органическом слое и определяли содержание ОНК. Содержание ДФГ в комплексе находили по разности. Результаты анализа комплексов, выделенных в твердом виде, представлены в таблице (таблица). ДФГ в комплекса находили по разности. Результаты анализа комплексов, выделенных в твердом виде, представлены в таблице.
Как следует из таблице, найденное содержание компонентов в комплексе удовлетворительно совпадает с рассчитанным по формулам Ln-ФЕН(ОНК)3 и Ln(ОНК)4∙НDФГ. При использовании графиков зависимости оптической плотности растворов комплексов в хлороформе от рН водной среды (рис. 2) методом наклона логарифмических прямых было установлено, что при образовании одной молекулы комплекса, как в отсутствие, так и в присутствии основания выделяются три иона водорода (рис. 5).
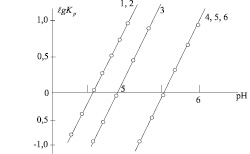
Рис. 5. Зависимость логарифма коэффициента распределения эрбия (1–3) и неодима (4–6) от рН водной фазы при экстрагировании их хлороформом в виде комплексов с ОНК (1, 4), ОНК+ФЕН (2, 5) и ОНК+ДФГ (3, 6)
Анализ 0-фенантролин, (дифенилгуанидин)-1-гидрокси-2-нафтойатных комплексов РЗЭ
|
Предполагаемая формула |
Посчитано согласно формуле, % |
Найдено, % |
Соотношение Ln:ОНК: основ |
||||
|
Ln |
ОНК |
основ |
Ln |
ОНК |
основ |
||
|
LaФЕН(ОНК)3 |
16,0 |
63,0 |
23,0 |
15,80 |
63,20 |
22,94 |
1:3,10:1,05 |
|
La(ОНК)4∙НDФГ |
16,0 |
62,0 |
24,0 |
16,08 |
62,14 |
24,08 |
1:3,80:1,12 |
|
NdФЕН(ОНК)3 |
16,0 |
62,0 |
22,0 |
16,12 |
62,09 |
21,88 |
1:3,05:1,06 |
|
Nd(ОНК)4 НDФГ |
16,0 |
61,0 |
24,0 |
15,90 |
61,20 |
24,08 |
1:4,02:1,0 |
|
GdФЕН(ОНК)3 |
18,0 |
62,0 |
22,0 |
18,06 |
62,08 |
21,90 |
1,0:3,0:1,03 |
|
Gd(ОНК)4∙НDФГ |
17,0 |
61,0 |
23,0 |
16,86 |
61,06 |
23,04 |
1,0:4,02:1,05 |
|
ErФЕН(ОНК)3 |
18,0 |
61,0 |
22,0 |
18,10 |
61,04 |
21,94 |
1,0:3,86:0,98 |
|
Er(ОНК)4∙НDФГ |
18,0 |
60,0 |
23,0 |
17,96 |
60,10 |
22,86 |
|
Таким образом, изученным комплексам могут быть приписаны следующие формулы, в которых координационное число ионов РЗЭ равно: