Загрязнение воздуха диоксидом серы и других вредных примесей, получаемых при сжигании угля, является одной из наиболее серьезных проблем, требующих незамедлительного решения. По данным статистики промышленные выбросы предприятий Казахстана в атмосферу составляют порядка трех миллионов тонн в год, из которых 85 % приходится на 43 крупные тепловые угольные электростанции и металлургические производства. Из всего количества источников выбросов загрязняющих веществ, имеющихся в республике, очистными сооружениями оборудовано всего лишь около 10 % источников [1].
Каждым отдельно взятым предприятием цветной металлургии в атмосферу ежегодно выбрасывается более 100 тыс. т сернистого ангидрида. Большинство зон высокого загрязнения атмосферного воздуха совпадает с местами концентрированного расселения людей. Тепловые электростанции, расположенные практически на всей территории республики, наносят еще больший вред окружающей среде и здоровью населения. Выбросы тепловых электростанций составляют до 70 % от общего объема эмиссий энергетического комплекса и 43,7 %, от эмиссии загрязняющих веществ в атмосферу. В выбросах различных источников Единой энергетической системы доминируют твердые частицы – 35 %, диоксид серы – 31 %, оксиды углерода и азота – 19 % и 14 %, соответственно [2].
Тепловые электростанции Казахстана, работающие преимущественно на углях с высоким содержанием серы (до 0,7 %) и золы (до 50 %), имеют КПД на уровне 33–35 %. Объекты электроэнергетики, построенные в 50-е и 70-е годы ХХ века, практически выработали производственный ресурс. Коэффициент износа основного электрооборудования, по предварительным расчетам на 2010 г., составляет 82 % [3].
Отсутствие надежной системы очистки дымовых газов с одной стороны, и использование старых методов улавливания SO2 и других вредных загрязнителей атмосферы с другой, привели к возрастанию их концентраций в выбросах выше предельно допустимых норм в разы.
В настоящее время на большинстве ТЭЦ очистка отходящих газов от газообразного SO2 выполняется пропусканием потока отходящего газа через известняк (CaCO3) или гашеную известь – Са(ОН)2, которые используются как в твердом виде, так и в виде водной суспензии [4]. Применительно к сегодняшним условиям сжигания угля эти методы не достаточно эффективны и обладают рядом недостатков: высокое остаточное содержание серы в газах (в лучшем случае 90 % SO2 удаляется из отходящих газов при его исходном содержании около 2 %); процессы довольно дорогие (при их применении стоимость электричества может увеличиться на несколько десятков процентов); большой выход не используемых твердых отходов (в основном, загрязненного примесями от сгорания угля, гипса – CaSO4), количество которых составляет несколько процентов от веса сжигаемого угля.
Одним из наиболее эффективных методов глубокой очистки отходящих газов от SO2 (остаток SO2 в газе < 0,001 % после очистки), является метод, основанный на поглощении SO2 расплавленной эвтектической смесью карбонатов щелочных металлов [5]. Несмотря на высокую эффективность, процесс не нашел широкого применения на практике, ввиду нерешенности вопроса дальнейшей регенерации получаемых сульфатно-карбонатных расплавов. По данной технологии процесс химической регенерации расплава необходимо проводить исключительно при высоких температурах ~ 850–900 °C, путем многоступенчатого химического процесса. При таких высоких температурах карбонатно-сульфатные расплавы становились очень агрессивными и реагировали практически со всеми материалами.
В настоящей работе приводятся результаты альтернативной технологии глубокой очистки отходящих газов от SO2 смесью жидких карбонатов щелочных металлов, с дальнейшей регенерацией полученных карбонатно-сульфатных расплавов путем восстановления монооксидом углерода – СО [6].
Материалы и методы исследования
В работе широко использованы современные методы физико-химических исследований процесса абсорбции серосодержащих отходящих газов ТЭЦ карбонатными расплавами щелочных металлов и регенерации сульфатно-карбонатных расплавов восстановительным газом СО.
При термодинамических расчетах реакций взаимодействия сернистого ангидрида с карбонатами щелочных металлов и реакций восстановления сульфатов щелочных металлов монооксидом углерода использовали специально разработанные авторами статьи программы.
Опыты по исследованию взаимодействия серосодержащих газов и золы, присутствующих в отходящих газах ТЭЦ, с карбонатными расплавами щелочных металлов, а также по извлечению серы из сульфатно-карбонатных расплавов проводили при низких температурах (480–550 °C). В экспериментах использовали эвтектическую карбонатную смесь состава, %: 43,5Li2CO3, 31,5Na2CO3, 25K2CO3. Сульфатно-карбонатную смесь готовили добавлением к карбонатному расплаву сульфата натрия в количестве 0,68 и 1,36 мМоль.
В проведенных опытах оценивали степень поглощения SO2 карбонатным расплавом и поведение золы при взаимодействии отходящих газов с расплавом.
В опытах по регенерации сульфатно-карбонатного расплава монооксидом углерода определяли степень полноты извлечения серы из расплава при продувке его монооксидом углерода (СО).
Результаты исследования и их обсуждение
Суть предлагаемой технологии заключается в следующем. При пропускании серосодержащих отходящих газов через расплавленную эвтектическую смесь карбонатов щелочных металлов (лития, натрия и калия) при 400–650 °С происходит взаимодействие SO2 с расплавленной эвтектической смесью по реакции:
Me2CO3 + SO2 = Me2SO3 + CO2. (1)
Эвтектическая карбонатная смесь, используемая в процессе, состоит, %:
Li2CO3-43,5, Na2CO3-31,5, K2CO3-25,0.
Смесь начинает плавиться при температуре 395 °С и при температуре выше 450 °С имеет низкую вязкость.
Образующиеся по реакции (1) сульфиты щелочных металлов, вступая во взаимодействие с кислородом, присутствующим в отходящих газах, будут одновременно окисляться до сульфатов (Me2SO4) по реакции:
Me2SO3 + 0,5O2 = Me2SO4, (2)
где Me − Li, Na, K.
Общий химизм процесса химической абсорбции SO2 карбонатным расплавом щелочных металлов можно описать суммарной реакцией, исходя из реакций (1) и (2):
Me2CO3 + SO2 + 0,5O2 = Me2SO4 + CO2. (3)
Полученный в результате взаимодействия SO2 с расплавом карбонатов щелочных металлов смесь, в основном, будет содержать сульфаты щелочных металлов, растворенные в эвтектической смеси карбонатов.
Результаты термодинамических расчетов значений свободной энергии Гиббса (∆GТ) реакций взаимодействия карбонатов щелочных металлов с SO2 по результирующей реакции (3) в температурном интервале 400…1000 °C показали высокую термодинамическую вероятность их взаимодействия (рис. 1).
На рис. 1 видно, что для реакций взаимодействия карбоната лития и натрия со смесью сернистого газа и кислорода значения свободной энергии Гиббса снижаются с увеличением температуры. Причем, при заданных температурах ведения процесса очистки отходящих газов 500–600 °C, значения ∆GТ для реакций, протекающих с присутствием карбонатов лития и натрия, меняются незначительно, и находятся практически на одном уровне ∆GТ = –243 кДж/моль. Это свидетельствует о том, что при взаимодействии отходящих газов со смесью карбонатного расплава, возможности образования сульфата лития и сульфата натрия равнозначны.
Несколько иная картина наблюдается при анализе протекания реакции карбоната калия со смесью сернистого газа и кислорода. С увеличением температуры направление и скорость протекания реакции с присутствием карбоната калия сильно сдвигается в сторону образования сульфата калия (рис. 1). Более высокое значение свободной энергии Гиббса ∆G = –270 кДж/моль данной реакции при температуре 500 °C, чем значения ∆G500 °C для выше рассмотренных реакций, свидетельствует о предпочтительности ее протекания.
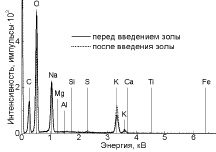
В результате экспериментальных исследований установлено, что в процессе химической абсорбции SO2 из отходящих газов карбонатным расплавом щелочных металлов улавливается до 95 % серы и практически вся летучая зола (рис. 2).
На рис. 2, а видно, что на EDS-спектре расплава, полученного после добавления золы в карбонатный расплав и выдержанного при температуре 550 °C в течение 10 часов, отсутствуют пики, относящиеся к компонентам золы (Al2O3, SiO2, Fe2O3, CaO, MgO). Это указывает на незначительную растворимость составляющих летучей золы в смеси карбонатных солей щелочных металлов. На рис. 2, б показано, что зола оседает в донной части расплава. По предлагаемой технологии осевшая зола легко может быть отделена от расплава механическим путем, например, отстаиванием.
Предварительными расчетами установлено, что при работе тепловых станций мощностью 335 МВт, для удаления SO2 из отходящих газов ~ 10 м3, требуется относительно небольшое количество расплава, так как реакция поглощения серы карбонатным расплавом щелочных металлов протекает с высокой скоростью. При этом после очистки отходящих газов, остаточное содержание SO2 в газах составляет ~ 0,003 %, что в 15 раз ниже, чем при использовании существующих процессов на основе известняка.
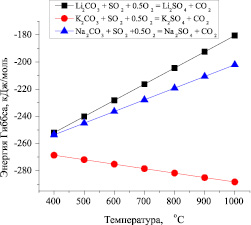
Рис. 1. Расчетные значения свободной энергии Гиббса (∆GТ) реакций взаимодействия карбонатов щелочных металлов со смесью SO2 и O2 от температуры

а) б)
Рис. 2. Результаты опытов по взаимодействию золы с карбонатным расплавом щелочных металлов. (A) − EDS спектры Li-Na-K эвтектики до и после взаимодействия с золой отходящих газов; (Б) − фотография закристаллизованного расплава после взаимодействия с золой. Темный слой в донной части образца (Б) соответствует осевшей пыли
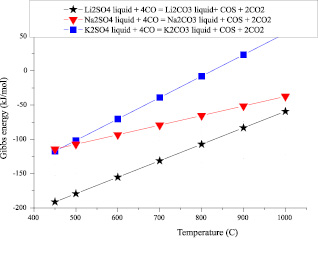
Рис. 3. Расчетные значения величины свободной энергии Гиббса от температуры для реакций восстановления сульфатов щелочных металлов монооксидом углерода
Расплав карбонатов, содержащий сульфаты щелочных металлов, подвергается дальнейшей регенерации. Процесс удаления серы из карбонатно-сульфатного расплава основан на восстановлении сульфатов щелочных металлов монооксидом углерода (СО) до их карбонатов с получением газообразного карбонилсульфида (COS) по реакции:
Me2SO4 + 4CO = Me2CO3 + COS + + 2CO2, (Me − Li, Na, K), (4)
Результаты термодинамических расчетов свободной энергии Гиббса реакций взаимодействия сульфатов щелочных металлов с СО в температурном интервале 400…1000 °C, приведенные на рис. 3, показывают высокую вероятность их восстановления до своих карбонатов с образованием в газовой фазе карбонилсульфида (COS) и диоксида углерода (СО2).
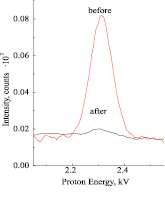
Рис. 4. Результаты спектрального анализа сульфатно-карбонатного расплава до и после обработки газом СО при 550 °C
Нетрудно видеть, что наибольшие отрицательные значения свободной энергии Гиббса (∆G450 °C = − 200 кДж/моль и ∆G600 °C = −150 кДж/моль) для рассматриваемых реакций, достигаются при низких температурных интервалах – 450…600 °C.
Результаты термодинамических расчетов полностью подтверждаются данными экспериментальных исследований. Спектральный анализ конечной пробы, полученной после обработки сульфатно-карбонатного расплава монооксидом углерода, показал практическое отсутствие в них спектров линии серы (рис. 4).
Установлено, что при восстановлении сульфатно-карбонатного расплава монооксидом углерода (СО) достигается максимальное (до 99,0 %) удаление серы в виде наиболее удобной газообразной форме карбонилсульфида (COS), пригодной для получения товарных продуктов – серной кислоты или элементарной серы.
Выводы
Предложенная в работе новая технология очистки серосодержащих отходящих газов обеспечивает решение двух очень важных для практики вопросов:
1. Повышение срока эксплуатации оборудования (при низких температурах 450–550 °C осуществления процессов абсорбции отходящих газов и регенерации сульфатно-карбонатных расплавов воздействие агрессивных расплавов щелочных металлов на оборудование минимально).
2. Возможность удаления серы из сульфатно-карбонатного расплава в наиболее удобной газообразной форме COS, пригодной для получения конечного продукта – серной кислоты или элементарной серы.

