Одной из актуальных задач современности является повышение степени эффективности извлечение тяжелых металлов из сточных вод. Известно, что тяжелые металлы являются стойкими химическими загрязнителями, обладающие специфическими токсическими свойствами.
В различных процессах химической технологии, адсорбционной очистки, разделения, выделения и концентрирования ценных компонентов из сточных вод применяются как синтетические, так и природные сорбенты. Последние десятилетия в виду высокой стоимости и дефицитности синтетических сорбентов стали уделять больше внимания природным сорбентам, таким как каолинит, монтмориллонит и других алюмосиликатов. Природные сорбенты нашли применение для решения экологических проблем: очистки сточных вод промышленных предприятий, содержащих тяжелые металлы [1, 2, 5, 6, 8, 9]. Мониторинг состояния водных ресурсов Тюменской области 2011 года [4] показал увеличение содержания в природной воде ионов меди.
В связи с этим целью настоящей работы явилось изучение сорбционной способности каолинита при извлечении ионов меди из водных растворов.
Материалы и методы исследования
Исследована сорбционная способность каолинита по отношению к катионам меди (II) на природном сорбенте – каолините. Для изучения процесса сорбции использовали 4 формы сорбента: природный минерал, Na-форма (обработан раствором NaCl), ОН-форма (обработан раствором NaOH), Н-форма (обработан раствором НCl). Для исследования использовали фракцию каолинита с размером частиц 2,5÷3,5 мм.
Эксперимент проводили при температуре 25 °С. Сорбцию катионов меди на каолините изучали в статических условиях из сульфатных растворов с концентрациями 0,05; 0,1; 0,2; 0,3; 0,5; и 1 ммоль/мл. Сорбент в разных формах в количестве 1 г заливали 50 мл растворами. Контакт сорбента с раствором продолжался до установления равновесия в течение 7 суток. Затем сорбент и раствор отделяли и анализировали на содержания ионов меди и измеряли рН среды. Концентрацию катионов меди в растворе определяли комплексонометрическим титрованием с трилоном Б в присутствии мурексида [12]. Количество вещества, сорбированного единицей массы сорбента Г, ммоль/г, рассчитывали по формуле:
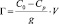 ,
,
где С0 – концентрация элемента в исходном растворе, ммоль/л; Ср – равновесная (остаточная) концентрация извлекаемого иона в растворе, ммоль/л; V – объем раствора, л; g – масса сорбента, г.
По полученным результатам строили изотермы сорбции, дающие основные сведения о сорбционных свойствах материала и характере сорбции на нем определенных веществ.
Результаты исследования и их обсуждение
Перед рассмотрением и анализом экспериментальных данных по изучению основных закономерностей сорбции катионов Cu (II), рассмотрим ионное состояние исходных растворов. В водных растворах свободные катионы меди практически не существуют вследствие сильной гидратации. В исследуемых растворах возможны гидратообразование с выделением нерастворимого гидроксида Cu(OH)2 и гидролиз катионов Cu2+.
В водных растворов медь образует четыре гидроксокомплекса, которые характеризуются следующими констант нестойкости: [Cu(OH)]+ (рK1 = 7,0); [Cu(OH)2] (рK1,2 = 13,68); [Cu(OH)3]– (рK1,2,3 = 17,0); [Cu(OH)4]2–(рK1,2,3,4 = 18,5) [3]. Кроме этого, в растворе существует сульфатный комплекс меди [CuSO4] (рK1 = 2,36) [10]. Такое поведение катионов меди будет оказывать влияние на результаты сорбции.
В процессе сорбции концентрация катионов меди в растворе снижается, что способствует гидролизу по уравнению
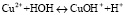 , (1)
, (1)
при этом происходит изменение водородного показателя среды. Величина рН может быть рассчитана из зависимости (Kw ионное произведение воды принято равное 10–14
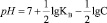 , (2)
, (2)
где КВ и С – соответственно константа диссоциации слабого основания, образующегося соль, по второй ступени, равная для Cu(OH)2 3,4∙10–7 [7, 10], и концентрация гидролизующих катионов, моль/л. Результаты расчетов по уравнению (2) представлены на рис. 1, а, из которого следует, что по мере снижения содержания ионов меди рН раствора возрастает.
Эти данные подтверждают и экспериментальные измерения рН растворов до и после сорбции ионов меди (рис. 1, б).
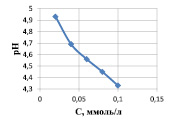
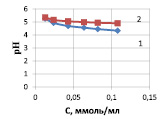
Рис. 1. Зависимость рН раствора сульфата меди от концентрации ионов Cu(II): а) расчетные данные по уравнению 2; б) исходных растворов до сорбции (1) и растворов после сорбции (2)
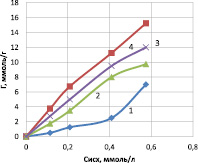
Рис. 2. Зависимость сорбции ионов меди из растворов сульфата меди на различных формах каолинита: 1 – каолинит, 2 – ОН – форма, 3 – Н – форма, 4 – Na – форма
Для установления закономерностей сорбции ионов меди на различных формах каолинита было изучено влияние концентрации исходного раствора на величину сорбции. В результате было установлено, что с увеличением концентрации ионов меди возрастает величина удельной сорбции. Полученные данные показывают, что солевая, щелочная и кислотная обработка каолинита приводит к увеличению сорбируемости ионов меди, по отношению к исходному сорбенту. Сорбционная емкость в солевой форме – 15,8; щелочной – 12,0; кислотной – 9,6; исходной – 7,4 ммоль/г.
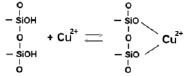
У исходного каолинита, по-видимому, имеет место блокировки его активных центров. С увеличением концентрации сорбция на исходном каолините возрастает и в области 0,2 ммоль/л наблюдается перегиб, указывающий на изменение механизма сорбции. На первой ступени сорбции меди предельное значение не достигается и выше отмеченной концентрации сорбция проходит одновременно на различных активных центрах. Сорбция проходит по ионообменному механизму по схеме:
Выявление сорбционных параметров предельной удельной сорбции Г∞ и константы, указывающей на сродство сорбата к сорбенту К, проведено обработкой результатов в соответствии с линейной формой уравнения Ленгмюра [11]:
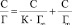 ,
,
где Г∞ – предельная емкость сорбента, ммоль/г; Г – количество сорбированных ионов Сu2+, ммоль/г; К – константа сорбционного взаимодействия, характеризующая интенсивность сорбции, л/ммоль, С – равновесная концентрация, ммоль/л.
Такая линейная изотерма (рис. 3) позволяет графически определить оба постоянных параметра адсорбционной изотермы Лэнгмюра (Г∞ и К). Экстраполяция прямолинейной изотермы до оси ординат дает отрезок, равный 1/Г∞∙К, а тангенс угла наклона прямой tg∞ = 1/Г∞ [8]. Рассчитанные значения постоянных уравнения Лэнгмюра приведены в таблицы.
Данные рис. 2 и расчеты параметров сорбции указывают на большее количество активных центров на сорбенте в солевой форме и при этом на значительно большее сродство этого сорбента к ионам меди по сравнению с природным каолинитом.
Параметр сорбционного взаимодействия (К) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше его величина. Значения К для солевой и щелочной форм каолинита близки друг к другу, что свидетельствует о незначительной разнице в структуре рассматриваемых веществ.
В отличии от монослойной модели Ленгмюра, модель Фрейндлиха не ограничивает число доступных адсорбционных центров, но предполагает их неоднородность [11]. Средние участки изотерм сорбции различными формами каолинита обрабатывали с помощью эмпирического уравнения Френдлиха:
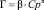 ,
,
где β и n – константы сорбционного процесса.
Рис. 3. Изотермы сорбции Сu2+ различными формами каолинита: 1 – каолинит, 2 – ОН – форма, 3 – Н – форма, 4 – Na – форма
Параметры сорбции Сu2+ из водных растворов различными формами калионита
|
Сорбент |
Г∞, моль/г |
К, л/ммоль |
β |
1/n |
|
каолинит |
10,0 |
0,50 |
1,80 |
0,47 |
|
Н – форма |
12,5 |
1,75 |
1,75 |
0,82 |
|
ОН – форма |
14,3 |
2,63 |
1,71 |
0,98 |
|
Na – форма |
16,6 |
5,00 |
1,65 |
1,09 |
Для определения констант β и n уравнение прологарифмировали:
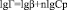 .
.
Параметр n в уравнении Фрейндлиха характеризует взаимодействие сорбент-сорбируемый компонент, параметр β характеризует скорость адсорбции и эффективность извлечения иона металла [11]. На основании анализа полученных констант выявлено, что Na- форма и ОН- форма проявляют более высокую адсорбционную активность при извлечении ионов меди из водных растворов.
Заключение
Определены сорбционно-структурные характеристики каолинита в разных формах. Установлено, что каолинит в солевой форме обладает более высокой сорбционной способностью по отношению к ионам меди по сравнению с природным каолинитом.
Изотермы сорбции ионов меди в широком интервале концентраций раствора сульфата меди подчиняется уравнению Ленгмюра; рассчитаны предельные значения сорбции.
По величине сорбционной способности каолинит в разных формах можно расположить в ряд: Na-форма > ОН-форма > Н – форма > природный каолинит.

