Сточные и промывные воды гальванического производства промышленных предприятий содержат в своем составе ионы тяжелых металлов – Fe, Cu, Cr, Pb, Zn, Ni, Cd. Cоединения тяжелых металлов вредно влияют на экосистему: водоем – почва – растения – животный мир – человек. Некоторые соединения способны погубить микроорганизмы очистных сооружений, а также замедлить процессы биологической очистки сточных вод.
Существуют различные способы очистки воды от катионов тяжелых металлов. Наиболее распространенным является сорбционная технология очистки сточных вод [5]. В качестве сорбентов используют различные искусственные и природные пористые материалы, имеющие развитую и специфическую поверхность. Все большее применение находят природные минеральные сорбенты в силу их относительно низкой стоимости и широкого распространения [1, 2, 9]. В Тюменской области содержится значительный запас легкоплавных глин, используемых для производства строительных материалов.
Целью работы является изучение сорбционной активности каолинита по отношению к ионам цинка.
Процесс ионного обмена на пористых сорбентах является сложным и многостадийным [3, 6]. На сорбционную способность каолинита влияет природа их обменного комплекса. В результате замены одних ионов на другие можно изменять свойства поверхности каолинита.
Природный каолинит представляет собой равномерное распределение высокодисперсных кристаллических силикатных частиц. Кристаллическая решетка состоит из двухслойных пакетов, в которых на одну сетку октаэдров приходится одна сетка кремнекислородных тетраэдров. Расстояние между тетраэдрическими и октаэдрическими слоями постоянно и равно 0,28 нм. Расстояние между пакетами составляет 0,72 нм. Кристаллики каолинита имеют вид хорошо выраженных шестиугольников размером до 0,3–0,4 мкм и толщиной 0,05–2,00 мкм, что соответствует удельной поверхности 1–22 м2/г.
Материалы и методы исследования
Для изучения процесса сорбции использовали 4 формы сорбента (каолинита): природный минерал; каолинит, обработанный: НCl (H-форма); NaCl (Na-форма) и NaOH (OH-форма). Химически модифицированные формы каолинита получали путем приведения в контакт природного сорбента с растворами соляной кислоты, гидроксида натрия и хлорида натрия в течение пяти суток при периодическом перемешивании.
Сорбцию катионов цинка изучали в статических условиях из нитратных растворов методом переменных концентраций [7]. Сорбционный эксперимент проводили из серии стандартных растворов, содержащих исследуемый ион металла от 0,1 до 1 моль/л. Сорбент в контакте с исследуемым раствором выдерживали в течение 5 суток при периодическом перемешивании. Эксперименты проводили при температуре (20 ± 2) °С. Соотношение «сорбент – раствор» составляло 1:100. Исходное и равновесное содержание ионов цинка в растворах определяли комплексонометрическим титрованием с индикатором эриохром черный Т в среде аммиачного буфера [4].
Результаты исследования и их обсуждение
О сорбционных свойствах каолинита можно судить по изотермам, характеризующим зависимость сорбционной способности от концентрации ионов цинка в растворах. Количественная адсорбция (Г) определяется избытком ионов на границе фаз по сравнению с равновесным количеством данных ионов в растворе. Экспериментально величину адсорбции ионов цинка вычисляли по уравнению:
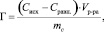
где Сисх. и Сравн. – исходная и равновесная концентрация ионов цинка, ммоль/мл; V – объем раствора, мл; m – масса сорбента (каолинита), г.
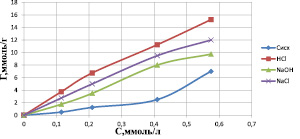
а)
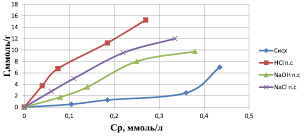
б)
Изотермы сорбции катионов цинка на различных формах каолинита в зависимости от (а) – концентрации исходного раствора, (б) – равновесной концентрации
По полученным данным строили изотермы адсорбции, которые дают основные сведения о сорбционных свойствах материала и характере сорбции на нем исследуемого вещества (рисунок).
Изотермы, полученные при сорбции ионов цинка на природном каолините, по внешнему виду похожи и по классификации БЭТ напоминают изотерму IV-a типа, которая характерна для сорбента со смешанной структурой [8].
Экспериментальные данные показывают, что модифицированные формы природного каолинита приводят к увеличению сорбируемости ионов цинка. С повышением равновесной концентрации удельная сорбция возрастает на всех изотермах и наблюдается перегиб, указывающий либо на изменение механизма, либо на наличие в сорбенте различных энергетически или пространственно доступных активных центров. При образовании исходных растворов нитратов цинка возможно протекание гидратообразования с выделением плохо растворимого гидроксида, а также гидролиз катионов цинка. Оба эффекта способны оказывать влияние на результаты сорбции.
Заключение
Исследуемый сорбент (каолинит) по величине обменной емкости близок к синтетическим органическим ионитам. Химическая модификация каолинита является эффективным способом повышения его сорбционной способности. Это позволяет предположить использование каолинита для очистки воды от ионов цинка, а также других тяжелых металлов.

