Рак молочной железы (РМЖ) является самой часто встречаемой злокачественной опухолью среди женского населения. В настоящее время в качестве прогностических факторов определяющих неблагоприятный исход заболевания и тактику лечения РМЖ помимо клинико-морфологичесих признаков определяют молекулярные показатели [9]. К таким показателям относят рецепторы к стероидным гормонам, например, рецептор прогестерона (PR). Экспрессия данного рецептора является показанием для назначения гормональной терапии пациентов с РМЖ. В клинической практике встречаются случаи с резистентностью к гормонотерапии больных, поэтому гормонально-рецепторный статус опухоли оказывается не всегда достаточным показателем гормональной чувствительности РМЖ [5].
Известно, что PR связывается с белком теплового шока 90 кДа (Heat shock protein 90 kDa, Hsp90) [10]. Hsp90 является одним из представителей семейства специализированных биомолекул, которые выполняя функции молекулярных шаперонов, играют основную роль в правильной укладке клеточных белков. При опухолевой трансформации наблюдается увеличение экспрессии Hsp90 в 2–10 раз больше, чем в нормальных клетках, что обеспечивает резистентность к воздействию неблагоприятных факторов [1, 3, 4, 6].
На молекулярном уровне активность шаперонов контролируется статусом его фосфорилирования и внутриклеточной локализацией [2]. Hsp90 имеет большое количество сайтов фосфорилирования, модификация которых, регулирует шаперонную активность и специфичность к определенным субстратным белкам. Известно, что данный белок экспрессируется в ядре и цитоплазме. Его ядерная локализация рассматривается как один из основных регуляторов транскрипции, а цитоплазматическая фракция выполняет шаперонную функцию более 200 белков. Например, Hsp90 участвует в функционировании различных протеинов, вовлеченных в неоплазию молочной железы (факторы транскрипции (HSF-1, HIF-1, р53), протеинкиназы (Akt, Cdk4, Cdk6), мутантные белки (р53mut), рецепторы стероидных гормонов (PR, ER), семейства ErbB и т.д.) [6, 7, 10]. Однако, регуляторное влияние особенностей внутриклеточного распределения в разном фосфорилированном статусе Hsp90 на экспрессию данных белков не исследована.
Таким образом, целью исследования явилась оценка связи особенности внутриклеточной локализации и фосфорилированного статуса Hsp90 с уровнем экспрессии PR в опухолевых клетках РМЖ.
Материалы и методы исследования
Исследован биопсийный материал опухолевой ткани молочной железы 15 пациенток с верифицированным диагнозом инвазивной карциномы неспецифического типа (ФГБУ Томского НИИ онкологии СО РАМН г.Томска). Для определения экспрессии рецептора PR использовали моноклональные антитела фирмы «Dako» (Дания) (клон PgR636, RTU, мышиные), при определении Hsp90 и его фосфорилированной формы (p-Hsp90 (phospho S226-Hsp90)) использовали антитела фирмы «Abcam» (Hsp90, мышиные, клон AC88; pospho S228 Hsp90, поликлональные кроличьи). Оценка PR, Hsp90 и p-Hsp90 проводилась иммуногистохимическим методом (ИГХ) по проценту позитивно окрашенных клеток. Оценивалась особенность внутриклеточной локализации Hsp90 (Hsp90-Я – ядерная локализация, Hsp90-Ц – цитоплазматическая локализация). Для оценки функциональной особенности Hsp90 был введен коэффициент внутриклеточного распределения – Квр – отношение процентного количества опухолевых клеток с ядерной локализацией (Hsp90-Я, % + р-Hsp90-Я, %) к сумме клеток с цитоплазматической локализацией Hsp90 (Hsp90-Ц, % + р-Hsp90-Ц, %). Статистическая обработка данных выполнялась с использованием пакета программ Statistica 7.0. Для оценки достоверности различий между группами проводили попарный анализ с использованием критерия Манна-Уитни. Оценка зависимости между количественными переменными проводилась по коэффициенту корреляции Спирмена (rs). Различия считались достоверными при уровне значимости р < 0,05.
Результаты исследования и их обсуждение
По результатам проведенного исследования 7 пациентов имели PR-позитивную экспрессию (40,0 (25,0–70,0) %) и соответственно 8 PR-негативную. Во всех 15 образцах опухолевого материала в инвазивном компоненте наблюдалась цитоплазматическая локализация шаперона (Hsp90-Ц 100 (98,3–100) %), из них у 1 больной была выявлена положительная экспрессия фосфорилированной формы белка в цитоплазме (p-Hsp90-Ц) 100 % опухолевых клеток. В ядре была представлена экспрессия только нефосфорилированной формы Hsp90 (Hsp90-Я 12,0 (2,5–66,8) %, N = 7). При этом отрицательная ядерная ИГХ-реакция на p-Hsp90 не свидетельствует об его полном отсутствии, так как известно, что около 3 % от общего клеточного пула Hsp90 присутствует в ядре и чувствительность ИГХ-метода может быть недостаточна для выявления малых количеств модифицированного белка. С другой стороны есть предположение, что ядерная модифицированная форма Hsp90 имеет другую пост-трансляционную модификацию и поэтому выявляется только в цитоплазме [7].
При сравнении количества клеток экспрессирующих Hsp90 по локализации с учетом его фосфорилированного статуса в зависимости от наличия экспрессии PR не было выявлено статистических различий. Однако анализ введенного нами коэффициента внутриклеточного распределения Hsp90 (Квр) показал достоверное (p = 0,034) увеличение данного показателя в группе с PR-положительной экспрессией (0,98 (0,69–0,99) у.е.) по сравнению с PR-негативной группой (0,03 (0,01–0,08) у.е.) (рис. 1).
Данное исследование выявило наличие положительной корреляционной связи между Квр и уровнем экспрессии PR (rs = 0,788, р = 0,035) (рис. 2). Так как экспрессия нефосфорилированной формы Hsp90 в цитоплазме наблюдалась практически во всех опухолевых клетках, то данная взаимосвязь Квр и экспрессии PR обусловлена отношением Hsp90-Я и p-Hsp90-Ц. Зависимость усиления экспрессии рецептора PR с Квр связана со снижением фосфорилированных форм Hsp90 в цитоплазме, вероятно, вследствие активности протеинкиназ/дефосфатаз при увеличении процесса транслокализации Hsp90 из цитоплазмы в ядро. Согласно литературным данным в ядре Hsp90 освобождает участки генома от нуклеосом, изменяет структуру гетерохроматина, способствует активированию РНК-полимеразы II и факторов транскрипции, что стимулирует транскрипцию различных генов [7]. Также известно, что Hsp90 имеет различные сайты фосфорилирования (Thr90, Thr115, Thr425, Thr603 и др.) [8]. В зависимости от модификации того или иного сайта в молекуле Hsp90 меняется не только его шаперонная активность (АТФ-азный цикл), но и специфичность к белкам-субстратам. Например, фосфорилирование Hsp90 Thr22 ослабляет его взаимодействие с Aha1 (активатор AТФ-азы Hsp90) и снижает шаперонную активность, фосфорилирование по Tyr309 приводит к увеличению функциональной активности eNOS (эндотелиальная NO-синтаза) [8]. По результатам нашего исследования следует, что увеличение Квр связано со снижением уровня цитоплазматического фосфопротеина Hsp90 (Ser226), который вероятнее всего является либо функционально неактивной формой, либо специфично угнетает шаперонную активность по отношению к PR.
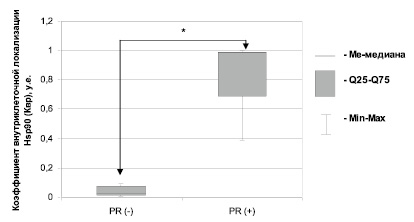
Рис. 1. Коэффициент внутриклеточного распределения Hsp90 (Квр) в зависимости от отсутствия/наличия окраски ИГХ-реакции рецептора прогестерона (PR (-)/PR (+)) в опухолевых клетках РМЖ. Примечание: * – достоверность различий р < 0,05
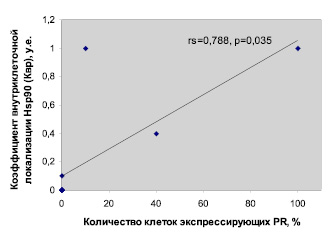
Рис. 2. Корреляционная зависимость коэффициента внутриклеточного распределения Hsp90 (Kвр) с количеством опухолевых клеток РМЖ экспрессирующих PR
Выводы
В опухолевых клетках РМЖ Hsp90 имеет низкий статус фосфорилирования и в основном представлен в цитоплазме. Экспрессия PR в опухолевых клетках РМЖ связана положительной корреляционной связью с соотношением в клетке ядерной нефосфорилированной формой и цитоплазматической фракцией p-Hsp90. Можно предположить, что воздействуя на механизм внутриклеточного распределения и фосфорилированный статус Hsp90 в опухолевых клетках РМЖ, будет изменяться экспрессия PR и как следствие чувствительность к гормонотерапии.
Работа выполнена при финансовой поддержке гранта Президента № МД-168.2014.7 и РФФФ 15-34-20864 мол_а_вед на оборудовании Томского регионального центра коллективного пользования, приобретенного при поддержке Минобрнауки России по Соглашению №14.594.21.000.

